Protocol terapeutic
conform ordin MS/CNAS NR 564/499/2021
C03XA01 – DCI TOLVAPTAN
C03XA01 – DCI TOLVAPTAN
Citeste mai mult: https://www.formaremedicala.ro/c03xa01-dci-tolvaptan/
Introducere
Scopul actualului protocol este de a prezenta indicația terapeutică a Tolvaptanului la pacienții
cu BPRTAD din România, precum și etapele necesare pentru inițierea, ajustarea, oprirea și
monitorizarea tratamentului
Boala polichistică renală cu transmitere autozomal dominantă (BPRTAD) reprezintă cea mai
frecventă afecțiune renală genetică și a 4-a cauză a bolii cronice de rinichi (BCR), având un
risc de transmitere genetic de 1 caz la 1000 de nașteri. În România prevalența estimată a bolii
este de 1,8 cazuri la 10.000 de locuitori. Această patologie se caracterizează prin dezvoltarea
și expansiunea continuă de chisturi renale multiple bilateral, ce determină alterarea arhitecturii
renale, mărirea în dimensiuni a rinichilor și pierderea progresivă a funcției renale.
Pacienții cu BPRTAD prezintă heterogenitate genetică și variabilitate fenotipică. În 78% din
cazuri este implicată o mutație a genei PKD 1, localizată pe cromozomul 16, ce codifică
policistina 1, în 15% din cazuri o mutație a genei PKD 2, localizată pe cromozomul 4, ce
codifică policistina 2, în 0,3% din cazuri este incriminat un defect al genei GANAB ce
codifică subunitatea alfa a glucozidazei II, în 0.1% din cazuri un defect al genei ALG9 sau
DNAJB11, iar în 7% din cazuri anomalia genetică este necunoscută. Mutațiile de tip truncat
sunt mai frecvente și se asociază cu un fenotip mai sever comparativ cu cele de tip nontruncat.
Evoluția naturală a bolii pentru majoritatea pacienților prezintă o etapă inițială de hiperfiltrare,
în care funcția renală se menține la valori normale, iar odată cu pierderea a ≥ 50% din nefronii
funcționali apare scăderea evidentă a ratei de filtrare glomerulară (RFG) și progresia către
BCR în stadiul final, la o vârstă medie de ~ 60 de ani. Pentru a evalua mai eficient
variabilitatea fenotipică din BPRAD, pacienții au fost divizați în două mari categorii, în
funcție de evoluția către necesitatea de substituție a funcției renale: evoluție lent progresivă și
rapid progresivă. S-a observat faptul că o serie de factori demografici, genetici, de mediu,
clinici și paraclinici se asociază cu severitatea, prognosticul, evoluția mai rapidă a BPRTAD
către BCR în stadiul final și pot explica variabilitatea fenotipică (Tabelul 1).
Interacțiunea complexă dintre acești factori prognostici influențează dezvoltarea și rata de
creștere a masei chistice, iar efectul lor cumulativ asupra fenotipului bolii legat de progresie
poate fi evaluat prin intermediul celor mai importante două metode validate în studii clinice:
volumul total renal ajustat pentru înălțime și vârstă (clasificarea Mayo) și rata de declin a
funcției renale.
Tabelul 1. Factori prognostici asociați cu severitatea și evoluția rapidă a BPRTAD:
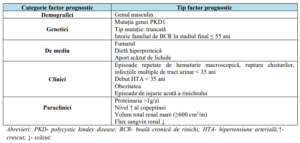
Identificarea pacienților la risc de a dezvolta forme rapid progresive de BPRTAD este
importantă în vederea implementării precoce a măsurilor terapeutice generale, dar mai ales
specifice de încetinire a progresiei. Managementul pacienților bazat strict pe aplicarea
măsurilor generale de tratament ale BCR și a tratamentului simptomatic sau al complicațiilor
este insuficient pentru a limita progresia bolii și degradarea funcției renale.
I. Indicația terapeutică (face obiectul unui contract cost volum)
Tolvaptanul este indicat pentru încetinirea progresiei dezvoltării chisturilor și a insuficienței
renale în BPRTAD, la pacienți adulți cu BCR stadiile G1-G3 la inițierea tratamentului și
dovezi de evoluție rapid progresivă a bolii.
II. Criterii pentru ințierea tratamentului
1. Criterii de includere
A. Vârsta peste 18 ani
Nota: la pacientii peste 55 de ani tratamentul se initiaza doar daca beneficiile depasesc
riscurile potentiale.
B. Diagnostic de BPRTAD [19]
Confirmarea diagnosticului de BPRTAD poate fi realizată astfel:
• Pentru pacienții cu istoric familial de BPRTAD: pe baza criteriilor imagistice
ultrasonografice unificate Pei-Ravine ,modificate în raport cu vârsta (Tabelul 2);
• Pentru pacienții fără istoric familial de BPRTAD: prin identificarea imagistică
(utilizând orice metodă imagistică) a cel puțin 10 chisturi, cu dimensiuni ≥ 5mm, pe
fiecare rinichi;
Tabelul 2. Diagnosticul BPRTAD conform criteriilor ultrasonografice unificate Pei-Ravine,
modificate în raport cu vârsta:

C. BCR stadiile G1-G3 (G3a și G3b)
• Se recomandă inițierea tratamentului cu Tolvaptan la pacienții cu RFGe ≥ 30
ml/min/1.73 m2 (stadiile G1-G3);
• Stadializarea bolii cronice de rinichi se va face pe baza ratei de filtrare glomerulară,
estimată prin formula CKD-EPI (Chronic Kidney Disease Epidemiology
Collaboration).
D. Formă rapid progresivă a bolii
Forma rapid progresivă a bolii poate fi documentată pe baza criteriului imagistic sau a celui
legat de funcția renală.
Criteriu imagistic
• Se recomandă ca criteriul imagistic să reprezinte principala metodă de evaluare a
formelor rapid progresive de BPRTAD, în vederea stabilirii eligibilității tratamentului
cu Tolvaptan.
• În cadrul evaluării este necesară măsurarea volumetriei renale totale ajustate pentru
înălțime și vârstă prin imagistică prin rezonanță magnetică (IRM) sau tomografie
computerizată (CT) de abdomen și pelvis, fără substanță de contrast, folosind
clasificarea Mayo. Aceasta se bazează pe măsurarea lățimii, înălțimii, lungimii în plan
sagital și în plan coronal, urmată de calcularea volumului renal printr-o ecuație
elipsoidă. Pentru calcul se poate accesa platforma online:
https://www.mayo.edu/research/documents/pkd-center-adpkd-classification/doc20094754.
• Pentru îndeplinirea criteriului este necesară încadrarea pacientului într-una din clasele
Mayo cu risc de progresie rapidă și morfologie tipică (1C, 1D, 1E).
• Pentru pacienții cu ax lung al rinichilor > 16.5 cm, identificat ecografic, și vârsta < 45
de ani este necesară confirmarea/infirmarea formei rapid progresivă prin măsurarea
volumetriei renale ajustată pentru înălțime și vârstă (clasă Mayo 1C-1E), pentru a
limita posibilitatea excluderii pacienților tineri cu ax lung < 16.5, dar formă rapid
progresivă, dar și pentru a reduce riscul interpretării eronate a formelor atipice de
BPRTAD sau a includerii pacienților cu forme lent progresive.
Criteriul funcției renale.
• Utilizarea acestui criteriu necesită disponibilitatea valorilor creatininei și a ratei de
filtrare glomerulară estimată prin formula CKD-EPI în dinamică. Un pacient poate fi
definit cu formă rapid progresivă a bolii pe baza declinului RFGe dacă:
– Există un declin susținut al RFGe cu ≥ 2.5 ml/min/1.73m2 pe an, pe o periodă
de 5 ani. Pentru îndeplinirea acestui criteriu se recomandă determinarea a cel
puțin 5 valori ale creatininei și RFGe pe perioada celor 5 ani, dintre care cel
puțin 1 determinare pe an, timp de 3 ani și condiția ca ultima determinare să fie
cu cel mult 6 săptămâni anterior evaluării pentru inițierea tratamentului cu
Tolvaptan.
– Există un declin susținut al RFGe cu > 5ml/min/1.73m2 pe parcursul a 12 luni.
Se recomandă determinarea a cel puțin 4 valori a creatininei serice, 1
determinare la 3 luni, pe parcursul unui an, iar ultima determinare să fie
realizată cu cu cel mult 6 săptămâni anterior evaluării pentru eligibilitatea
tratamentului cu Tolvaptan.
• În situația în care pacientul îndeplinește criteriul funcției renale de progresie rapidă a
bolii, dar asociază concomitent alți factori de risc ce pot influența declinul RFGe
[proteinurie ≥1 g/zi, hipertensiune arterială severă necontrolată , diabet zaharat,
afecțiuni vasculare ( boală coronariană ischemică, accident vascular cerebral),
administrare de medicație cu potențial nefrotoxic)] este indicată aplicarea criteriului
imagistic în mod complementar pentru a evalua riscul de progresie rapidă ( clasele
Mayo 1C-1E).
2. Criterii de excludere
Criteriile de excludere se aplică anterior inițierii Tolvaptanului și se adresează situațiilor în
care medicament nu și-a dovedit eficiența sau în cazul în care acesta este contraindicat.
A. Vârsta < 18 ani sau ≥ 56 de ani*
B. Forma atipică de BPRTAD ( clasă Mayo 2)
C. BCR stadiile G4-G5 ( inclusiv dializă și transplant)
D. Formă lent evolutivă a bolii (clasă Mayo 1A și 1B)
E. Contraindicații (vezi contraindicații)
*la pacientii peste 55 de ani tratamentul se initiaza doar daca beneficiile depasesc riscurile potentiale.
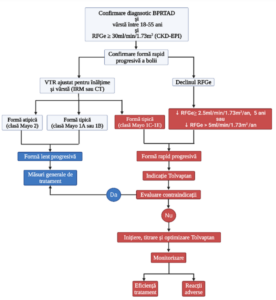
Figura 1. Algoritm de evaluare a eligibilității pentru tratamentul cu Tolvaptan și monitorizare
(Abrevieri: BPRTAD- boală polichistică renală cu transmitere autozomal dominantă; RFGerată de filtrare glomerulară estimată; CKD-EPI- Chronic Kidney Disease Epidemiology
Collaboration; VTR- volum total renal; IRM- imagistică prin rezonanță magnetică; CTtomografie computerizată;
III. Tratament
1. Medicament
Tolvaptanul este un antagonist selectiv al receptorului V2 al vasopresinei localizat la nivelul
membranei bazolaterale a celulei principale din tubul colector și conector a nefronului distal.
Prin blocarea acțiunii vasopresinei pe receptorul V2, Tolvaptanul produce scăderea AMPc
intracelular, inhibarea proliferării celulare și a secreției fluide, respectiv inhibarea formării
chisturilor, încetinirea progresiei sau regresia acestora. Prin aceste mecanisme Tolvaptanul
reduce creșterea volumetriei renale și încetinește progresia bolii cronice de rinichi la pacienții
cu BPRTAD, oferind nefroprotecție. Afinitatea Tolvaptanului pentru receptorul V2 este de
1,8 ori mai mare decât cea a vasopresinei endogene.
2. Compoziția
Un comprimat conține substanța activă (Tolvaptan) și excipienți (amidon de porumb,
hidroxipropilceluloză, lactoză monohidrat, stearat de magneziu, celuloză microcristalină, lac
de aluminiu indigo carmin).
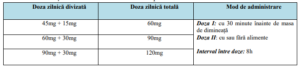
3. Doza și modul de administrare
• Tolvaptanul trebuie administrat oral în doză zilnică totală de 60mg, 90mg sau 120mg,
în funcție de tolerabilitate, divizată în două prize pe zi, doza de dimineață fiind mai
mare decât cea de după-amiază;
• Doza de dimineață este recomandat să se administreze cu cel puțin 30 de minute înainte
de micul dejun, iar doza de după-amiază poate fi luată cu sau fără alimente la interval de
8h distanță de doza de dimineață, preferabil anterior orei 4 p.m. pentru a diminua riscul
de nicturie. (Tabelul 3);
• Comprimatele trebuie înghițite fără să fie mestecate, cu un pahar cu apă. Tolvaptanul nu
trebuie administrat cu suc de grapefruit.
Tabelul 3. Doza și modul de administrare a Tolvaptanului:
4. Ajustarea dozelor
• Doza inițială recomandată de Tolvaptan este de 60 mg/zi, divizată în 2 prize ( 45 mg +
15 mg), prima priza de 45 mg administrată înainte de masa de dimineață, iar cea de a
doua priză de 15 mg, administrată 8h mai târziu. Ulterior, se recomandă ajustarea
treptată a dozei inițiale, în sens crescător, la o doză divizată de 90 mg/zi (60 mg + 30
mg), respectiv la 120 mg/zi (90 mg + 30 mg). Escaladarea treptată a dozelor se
recomandă să fie efectuată la intervale cel puțin săptămânale, în funcție de
tolerabilitate;
• În caz de intoleranță (poliurie/polidipsie excesivă, hipernatremie, creșterea creatininei
între 20-30% din valoarea de bază), dozele pot fi ajustate treptat în sens descrescător,
dar cu păstrarea divizării dozelor și menținerea dozei mai mari în prima parte a zilei;
• Se recomandă menținerea dozei maxime tolerate de Tolvaptan;
• Deoarece Tolvaptanul este metabolizat intens la nivelul ficatului, aproape exclusiv de
către CYP3A, în cazul tratamentului concomitent cu inhibitori puternici sau moderați
ai CYP3A (Atazanavir, Claritromicină, Darunavir, Indinavir, Itraconazol,
Ketoconazol, Lopinavir, Mifepristonă, Ombitasvir-paritaprevir-ritonavir, Ombitasvirparitaprevir-ritonavir + dasabuvir, Posaconazol, Ritonavir, Voriconazole) este
necesară reducerea dozelor de Tolvaptan, prin administrarea într-o singură priză pe zi,
conform precizărilor din Tabelul 4:
Tabelul 4. Ajustarea dozelor de Tolvaptan în contextul utilizării concomitente de inhibitori
puternici ai CYP3A:
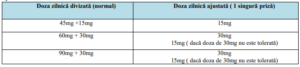
• În cazul tratamentului concomitent cu inhibitori moderați ai CYP3A (Diltiazem,
Verapamil, Dronedarone, Eritromicină, Fluconazol, Imatinib, Nilotinib, sucul de
grapefruit), reducerea dozelor de Tolvaptan se va face menținându-se administrarea în
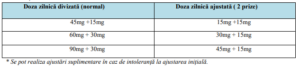
două prize, conform precizărilor din Tabelul 5:
Tabelul 5. Ajustarea dozelor de Tolvaptan în contextul utilizării concomitente de inhibitori
moderați ai CYP3A:
5. Reacții adverse
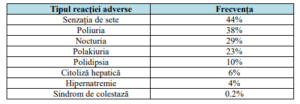
• Cele mai frecvente reacții adverse la administrarea de Tolvaptan sunt descrise în
Tabelul 6;
• Se recomandă informarea pacientului anterior inițierii tratamentului, cu privire la
potențialele reacții adverse, frecvența apariției lor, impactul pe calitatea vieții și
educarea cu privire la măsurile ce pot reduce sau corecta apariția acestora.
Tabelul 6. Reacții adverse frecvente la administrarea de Tolvaptan:
IV. Contraindicații
1. Hipersensibilitate la substanța activă, la oricare dintre excipienți, la benzazepină sau
derivați de benzazepină ;
2. Valori crescute ale enzimelor hepatice și/sau semne sau simptome de afectare
hepatică înainte de începerea tratamentului, care îndeplinesc criteriile pentru oprirea
definitivă a tratamentului cu Tolvaptan ;
3. Anurie;
4. Hipovolemie;
5. Hipernatremie;
6. Pacienți care nu pot percepe sau răspunde la senzația de sete;
7. Sarcină ;
8. Alăptare;
9. Obstrucția necorectabilă a tractului urinar.
V. Atenționări și precauții speciale pentru utilizare
1.Hepatotoxicitate
• Se recomandă determinarea ALT (alanilaminotransferaza), AST
(aspartataminotransferaza) și a bilirubinei totale anterior inițierii tratamentului cu
Tolvaptan, la 2 săptămâni și 4 săptămâni după inițiere, apoi lunar timp de 18 luni și
ulterior, la fiecare 3 luni;
• Se recomandă monitorizarea concomitentă a simptomelor sugestive pentru injuria
hepatică (fatigabilitate, anorexie, greață, durere în hipocondrul drept, vărsături, febră,
erupții cutanate tranzitorii, prurit, urină hipercromă sau icter);
• Nu se recomandă inițierea tratamentului la pacienți cu citoliză hepatică care au criterii
de oprire permanentă a medicamentului (vezi Criterii pentru oprirea temporară sau
permanentă a Tolvaptanului);
• Oprirea temporară sau permanentă a medicamentului se ca face în funcție de valoarea
transaminazelor, dinamica lor și a simptomelor ( vezi Criterii pentru oprirea temporară
sau permanentă a Tolvaptanului).
2. Poliuria, polidipsia, hipovolemia și aportul de apă
• Se recomandă consilierea pacienților anterior inițierii tratamentului cu Tolvaptan cu
privire la apariția senzației de sete, accesul la apă, aportul adecvat de apă (cel puțin 2-
3L/zi), potențialelor reacții adverse asociate și a impactului asupra calității vieții;
• Se recomandă informarea pacienților anterior inițierii tratamentului cu Tolvaptan cu
privire la apariția poliuriei ca cel mai frecvent efect advers posibil, cât și al nicturiei;
• Este necesară informarea cu privire la orarul de adminstrare al celei de a doua doze
înainte de ora 16:00 pentru a preveni nicturia excesivă;
• Se recomandă implementarea de măsuri suplimentare dacă poliuria devine o
complicație ce influențează aderența la tratament: implementarea unei diete hiposodate
(<2g sare/zi), reducerea dozei de Tolvaptan ( mai ales a celei de a doua prize, daca
nicturia este principala problemă);
• Nu se recomandă asocierea de diuretice tiazidice pentru a reduce poliuria;
• Pacienții trebuie instruiți să bea apă la primul semn de sete, în scopul de a evita setea
excesivă sau deshidratarea;
• Se recomandă monitorizarea regulată a greutății corporale și a raportului seric
creatinină/uree.
3. Hipernatremia
• Prezența hipernatremiei anterior inițierii tratamentului reprezintă o contraindicație de
administrare a Tolvaptanului;
• Apariția hipernatremiei după inițierea tratamentului cu Tolvaptan poate fi prezentă în
~4% din cazuri, de obicei corectabilă după creșterea aportului de apă și/sau scăderea
dozelor, rar fiind o cauză de oprire a tratamentului;
• Se recomandă monitorizarea regulată a sodiului plasmatic.
4. Hiperuricemie
• Administrarea de Tolvaptan poate induce hiperuricemie și risc de apariție a gutei prin
scăderea excreției urinare de acid uric, dar acestea reprezintă rar o indicație de oprire a
medicamentului;
• Nivelul seric al acidului uric ar trebui monitorizat regulat.
5. Patologie reno-urinară obstructivă
• Pacienții cu patologie obstructivă de tract reno-urinar (ex: hipertrofie de prostată)
prezintă un risc crescut de a dezvolta retenție acută de urină în contextul utilizării de
Tolvaptan, prin urmare necesită monitorizarea atentă a volumului urinar și eventual
evaluare ecografică.
VI. Monitorizarea tratamentului și criterii de evaluare a eficacității terapeutice
În prezent nu există markeri specifici de evaluare a eficienței Tolvaptanului asupra încetinirii
ratei de progresie a bolii. Deși, scăderea osmolalității urinare asociată cu prezența poliuriei și
un nivel crescut al copeptinei serice ar putea reflecta aderența și răspunsul la tratament, nu
există suficiente date pentru a recomanda determinarea lor de rutină în practica curentă (are o
valoare limitată la nivel individual).
La acest moment monitorizarea eficienței tratamentului se bazează pe evaluarea:
• ratei anuale de declin a RFGe observată față de cea anticipată, pe baza determinărilor
creatinei serice în decursul unui an
• ratei de creștere a volumului total renal prin evaluare IRM sau CT la 3 ani, utilizând
clasificarea Mayo
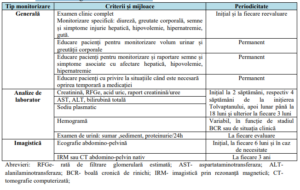
Tabelul 7. Recomandări generale de monitorizare
VII. Criterii pentru oprirea temporară sau permanentă a Tolvaptanului
1. Oprirea temporară:
• În cazul confirmării valorilor susținut crescute sau în creștere ale transaminazelor ≤ 2
ori a limitei superioare a valorii normale (LSVN). Dacă la 48-72h de la oprirea
temporară a Tolvaptanului se observă creșterile semnificative (≥ 3 ori LSVN) și/sau
simptomele clinice de afectare hepatică se recomandă oprirea permanentă a
medicamentului. Dacă la 48-72h de la oprirea temporară a Tolvaptanului, valorile
ALT și AST se mențin < 3 ori valoarea LSVN sau se normalizează, tratamentul poate
fi continuat cu precauție, cu monitorizare frecventă, la doze similare sau inferioare,
deoarece valorile transaminazelor par să se stabilizeze la continuarea tratamentului la
unii pacienți;
• În contextul unor situații ce cresc riscul de deshidratare: vărsături, diaree, transpirații
profuze, aport limitat de lichide.
• Cu 24-48h anterior unei intervenții chirurgicale și reluare în momentul în care
pacientul este capabil de hidratare adecvată;
• În situația creșterii creatininei serice cu > 30% din valoarea de bază.
• De menționat faptul că este obligatorie educarea pacienților cu privire la situațiile când
este necesară oprirea temporară a medicației.
2. Oprirea definitivă:
• ALT sau AST > 8 ori LSVN;
• ALT sau AST > 5 ori LSVN, pentru mai mult de 2 săptămâni;
• ALT sau AST > 3 ori LSVN și (BT > 2 ori LSVN sau raportul internațional normalizat
[INR] > 1,5);
• ALT sau AST > 3 ori LSVN cu simptomele persistente de afectare hepatică
(fatigabilitate, anorexie, greață, durere în hipocondrul drept, vărsături, febră, erupții
cutanate tranzitorii, prurit, urină hipercromă sau icter);
• Evoluția pacientului către BCR stadiul G5 (RFGe < 15ml/min/1.73m2
);
• Anafilaxie la administrarea medicamentului.
VIII. Prescriptori
Tratamentul va fi inițiat, continuat si monitorizat de medicii din specialitatea nefrologie.”
Cele mai noi stiri medicale: