Protocol terapeutic
conform ordin MS/CNAS NR 564/499/2021
R07AX32 – DCI IVACAFTORUM + TEZACAFTORUM + ELEXACAFTORUM
R07AX32 – DCI IVACAFTORUM + TEZACAFTORUM + ELEXACAFTORUM
Citeste mai mult: https://www.formaremedicala.ro/r07ax32-dci-ivacaftorum-tezacaftorum-elexacaftorum/
1. INDICAȚII TERAPEUTICE
IVACAFTORUM+ TEZACAFTORUM+ELEXACAFTORUM (IVA/TEZ/ELX) este indicat, în
cadrul unei scheme de administrare în asociere cu ivacaftor 150 mg comprimate, pentru
tratamentul fibrozei chistice (FC) la pacienți cu vârsta de 12 ani și peste, care sunt homozigoți
pentru mutația F508del a genei regulatorului de conductanță transmembranară al fibrozei chistice
(CFTR) sau care sunt heterozigoți pentru mutația F508del a genei CFTR
2. CRITERII DE INCLUDERE
• Pacienții diagnosticați cu fibroză chistică având mutațiile mai sus menționate
• Vârsta peste 12 ani
• Test genetic care să confirme prezența mutațiilor menționate anterior
• Consimțământ informat: tratamentul va fi început numai după ce pacienții sau părinții
respectiv tutorii legali ai acestora au semnat consimțământul informat privind administrarea
medicamentului, acceptarea criteriilor de includere, de excludere și de oprire a
tratamentului, precum și acceptul de a se prezenta periodic la evaluările recomandate.
3. CRITERII DE EXCLUDERE
• Vârsta sub 12 ani
• Pacienții cu fibroză chistică care nu prezintă una din mutațiile menționate anterior
• Refuzul semnării consimțământului informat privind administrarea medicamentului, a
criteriilor de includere, excludere respectiv de oprire a tratamentului precum și acceptul de
a se prezenta periodic la evaluările recomandate.
• Pacienții cu intoleranță la galactoză, cu deficit total de lactază sau cei cu sindrom de
malabsorbție la glucoză-galactoză .
4. CRITERII DE OPRIRE A TRATAMENTULUI
• Pacient necompliant la evaluările periodice
• Renunțarea la tratament din partea pacientului
• Întreruperea din cauza reacțiilor adverse
• Absența eficienței
Se consideră că tratamentul este eficient dacă se constată :
– Scăderea valorii obținute la testul sudorii cu 20 mmol/l sau cu cel puțin 20 % din
valoarea inițială sau
– creșterea FEV1 cu cel puțin 5% din valoarea preexistentă la spirometria de la 12 luni
– Reducerea cu 20% a exacerbărilor pulmonare
– Îmbunătățirea BMI
• Creșteri semnificative ale transaminazelor (de exemplu, pacienții cu ALT sau AST ce
cresc de mai mult de 5 ori peste limita superioară a normalului [LSN] sau ALT ori AST ce
cresc de mai mult de 3 ori peste LSN si sunt asociate cu bilirubină ce creste de mai mult de
2 ori peste LSN). In aceste cazuri administrarea dozelor trebuie întreruptă până la
normalizarea valorilor paraclinice observate. Ulterior va fi evaluat raportul intre beneficiile
expectate și riscurile posibile ale reluării tratamentului si se vor lua decizii conforme cu
acest raport risc/beneficiu.
5. DOZE SI MOD DE ADMINISTRARE
Forma de prezentare
Kaftrio 75 mg/50 mg/100 mg comprimate filmate
IVA/TEZ/ELX se poate iniția doar de către medicii care își desfășoară activitatea in centre
destinate evaluării si tratamentului fibrozei chistice și doar la pacienții cu mutațiile descrise
anterior. Dacă genotipul pacientului nu este cunoscut, înainte de începerea tratamentului trebuie
aplicată o metodă de genotipare precisă și validată, pentru a confirma prezența mutațiilor indicate
in criteriile de includere.
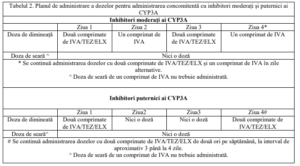
Tabel 1. Administrare IVA/TEZ/ELX în terapie combinată cu Ivacaftor

Administrare:
IVA/TEZ/ELX trebuie administrat sincron cu alimente având un conținut lipidic, la o masă sau
gustare la care se asociază enzime pancreatice. Pacienții trebuie instruiți să înghită comprimatele
întregi. Comprimatele nu trebuie mestecate, zdrobite sau sparte înainte de ingerare.
Doza de dimineață și cea de seară trebuie luate la interval de aproximativ 12 ore, cu alimente care
conțin lipide
Doză omisă
Dacă au trecut 6 ore sau mai puțin de la doza de dimineață sau de seară omisă, pacientul trebuie să
ia doza omisă cât mai curând posibil și să continue conform schemei inițiale.
Dacă au trecut mai mult de 6 ore de la:
• doza de dimineață omisă, pacientul trebuie să ia doza omisă cât mai curând posibil și nu
trebuie să ia doza de seară. Următoarea doză de dimineață programată trebuie luată la ora
obișnuită.
• doza de seară omisă, pacientul nu trebuie să ia doza omisă. Următoarea doză de dimineață
programată trebuie luată la ora obișnuită.
Doza de dimineață și cea de seară nu trebuie administrate în același timp.
IVA/TEZ/ELX nu se administrează cu suc de grape-fruit sau de portocale roșii .
Contraindicații: IVA/TEZ/ELX nu se administrează la pacienți cu hipersensibilitate la substanța
activă sau la oricare dintre excipienți
Atenționări și precauții speciale:
La administrarea concomitentă cu inhibitori moderați ai CYP3A (de exemplu, fluconazol,
eritromicină, verapamil) sau inhibitori puternici ai CYP3A (de exemplu, ketoconazol, itraconazol,
posaconazol, voriconazol, telitromicină și claritromicină), doza trebuie redusă conform Tabelului 2
Grupe speciale de pacienți
Vârstnici
Nu se recomandă ajustarea dozei la pacienții vârstnici
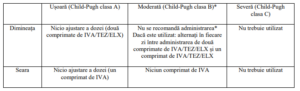
Insuficiență hepatică
Nu se recomandă tratamentul la pacienții cu insuficiență hepatică moderată (Child-Pugh clasa B).
La pacienții cu insuficiență hepatică moderată, utilizarea Kaftrio trebuie avută în vedere numai
atunci când există o indicație medicală clară și se preconizează că beneficiile depășesc riscurile.
Dacă este utilizat, trebuie să se administreze cu precauție, într-o doză redusă (vezi Tabelul 3). Nu sau efectuat studii la pacienți cu insuficiență hepatică severă (Child-Pugh clasa C), însă se
preconizează ca expunerea să fie mai mare decât la pacienții cu insuficiență hepatică moderată.
Pacienții cu insuficiență hepatică severă nu trebuie tratați cu Kaftrio. Nu se recomandă ajustarea
dozei la pacienții cu insuficiență hepatică ușoară (Child-Pugh clasa A).
Tabelul 3: Recomandări de utilizare la pacienții cu insuficiență hepatic
![]()
Insuficiență renală
Nu este necesară ajustarea dozei pentru pacienții cu insuficiență renală ușoară și moderată. Nu
există experiență la pacienții cu insuficiență renală severă sau cu boală renală în stadiul terminal.
Pacienți după un transplant de organ Nu s-a studiat administrarea IVA/TEZ/ELX în asociere cu
IVA la pacienții cu FC cărora li s-a efectuat un transplant de organ. Prin urmare, utilizarea la
pacienți cu transplant nu este recomandată.
Tabel 4. Interacțiuni medicamentoase
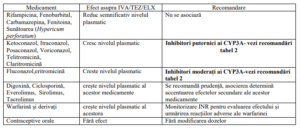
Notă : studiile despre interacțiunile medicamentoase s-au efectuat doar la pacienții adulți.
Cat privesc sarcina și alăptarea nu există date suficiente. Ca măsură de precauție, este de preferat să
se evite utilizarea IVA/TEZ/ELX în timpul sarcinii. In ceea ce priveste alăptarea nu se poate
exclude un risc pentru nou-născuți/sugari. Trebuie luată decizia fie de a întrerupe alăptarea, fie de a
întrerupe/de a se abține de la tratamentul cu IVA/TEZ/ELX având în vedere beneficiul alăptării
pentru copil și beneficiul tratamentului pentru femeie. obținute din sarcini).
Poate produce amețeală, deci este necesara prudența în timpul condusului.
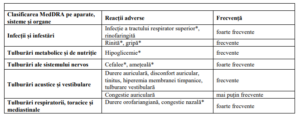
Tabelul 5. Reacții adverse
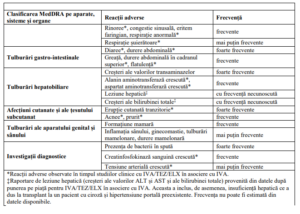
6. MONITORIZAREA PACIENȚILOR ÎN CADRUL PROGRAMULUI DE TRATAMENT
CU IVACAFTORUM+ TEZACAFTORUM+ELEXACAFTORUM
La includerea în Programul de tratament cu IVA/TEZ/ELX se va completa Fișa de evaluare
clinică inițială (anexa 1) la care se vor anexa documentele medicale care confirmă diagnsoticul
pacientului ( test genetic, testul sudorii, scrisoare medicală).
Monitorizarea pacientului pe parcursul tratamentului cu IVA/TEZ/ELX:
• Inițierea tratamentului (anexa 1)
• Luna a 1/3/6/9/ a de la inițierea tratamentului ( anexa 2) , datele fiind completate
conform planului de monitorizare
• Luna a 12 -1 și ulterior anual ( anexa 3)
• Evaluarea complianței la tratament, verificarea modului de administrare a tratamentului si
al medicației concomitente ce poate interfera cu acțiunea IVA/TEZ/ELX, precum și
prezența efectelor adverse, se vor efectua la fiecare vizită de monitorizare.
Monitorizarea pacientului în tratament cu IVA/TEZ/ELX va fi personalizată (ca interval de
monitorizare) în funcție de gradul de afectare hepatică/renală si de complicațiile bolii de fond.
Anexa 1 va fi transmisă de Centrele de Fibroză chistică/mucoviscidoză la CNAS în vederea luării
în evidență a pacienților, iar Anexa 3 la fiecare 12 luni de la inițierea tratamentului.
Anexa 2 va fi transmisă de Centrele de Fibroză chistică/mucoviscidoză la CNAS în situația
deciziei de întrerupere definitivă a tratamentului
7. PRESCRIPTORI
Medici din specialitatea pediatrie, pneumologie pediatrică, pneumologie, cu experiență în
diagnosticul și tratamentul fibrozei chistice, care vor întocmi dosarul de inițiere al tratamentului si
vor emite prima prescriptie medicală pentru o perioada de maxim 30/31 zile de tratament. Este
recomandat ca medicii prescriptori să facă parte din unul din Centrele Regionale de fibroză chistică
unde se pot asigura condițiile necesare monitorizării adecvate pentru acești pacienți. După inițierea
tratamentului, continuarea acestuia se poate face de medicii din specialitatea pediatrie,
pneumologie pediatrică, pneumologie din teritoriu sau de către medicul de familie în baza scrisorii
medicale sau a biletului de ieșire de la medicul coordonator.
Recomandarea pentru inițierea tratamentului se face după evaluarea pacientului și a dosarului
acestuia și după confirmarea diagnosticului. Se menționează perioada pentru care va fi prescris
tratamentul (care nu va fi mai mare de 6 luni in primul an de tratament si 12 luni ulterior , cu
reevaluare în vederea continuării).
DOSARUL DE INIȚIERE A TRATAMENTULUI trebuie să cuprindă următoarele
documente:
1. Datele de identificare (copii după certificat de naștere, carte de identitate);
2. Consimțământul informat al părintelui (tutorele legal) al copilului sau al
bolnavului (dacă are vârsta peste 18 ani) (anexa 4 a prezentului protocol);
3. A fost completat consimțământul de la părinți și/sau pacient pentru acord privind
administrarea:
_DA _ NU
4. Bilet de externare sau scrisoare medicală dintr-un Centru de Fibroză Chistică care să
ateste diagnosticul de fibroză chistică / mucoviscidoză si indicatia de tratament.
5. Buletin de testare genetică care să ateste mutațiile specificate în indicațiile terapeutice ale
preparatului
6. Evaluarea inițială – clinică și paraclinică (anexa 1 a prezentului protocol);
7. Tratament concomitent (care ar impune modificarea dozelor terapeutice
Anexa 1
Centrul de Fibroză chistică /mucoviscidoză
……………………………………………………………………….
Fișa de evaluare inițială în vederea includerii în tratament cu IVA/TEZ/ELX a
pacientului cu Fibroză chistică/mucoviscidoză

Anexa 2
Fișa de monitorizare a pacientului cu Fibroză chistică/mucoviscidoză în tratament cu IVA/TEZ/ELX
Centrul de Fibroză chistică/mucoviscidoză
……………………………………………………………………….
Tip evaluare
[ ] 1 luni; [ ]3 luni; [ ] 6 luni; [ ]9 luni;

Anexa 3
Fișa de monitorizare a pacientului cu Fibroză chistică/mucoviscidoză în tratament cu
IVA/TEZ/ELX
Centrul de Fibroză chistică/mucoviscidoză
………………………………………………………………………
Tip evaluare
[ ]12 luni de la inițiere/ [ ]anual Anul inițierii tratamentului cu IVA/TEZ/ELX……

Anexa 4
FORMULAR PENTRU CONSIMȚĂMÂNTUL PACIENTULUI CU FIBROZA CHISTICĂ
ELIGIBIL PENTRU TRATAMENT CU IVA/TEZ/ELX
Subsemnatul(a) ……………………………………………………………………………………….……………, cu
CI/BI
…………………..…… pacient /părinte/tutore legal al copilului ……………..………………………………….cu
CNP ………………………………… diagnosticat cu fibroză chistică și genotip DF508 homozigot sau
heterozigot cu o mutație cu funcție minimă am fost informat de către
…………………………..………………… privind tratamentul medical al bolii cu IVA/TEZ/ELX .
Kaftrio este un medicament care conține substanțele active ivacaftor (ivacaftorum) 75 mg, tezacaftor
(tezacaftorum) 50 mg și elexacaftor (elexacaftorum) 100 mg sub formă de comprimate.
Kaftrio se utilizează în tratamentul pacienților cu fibroză chistică cu vârste de peste 12 ani și adulți care
au una din mutațiile descrise anterior. Efectul combinat al ELX, TEZ și IVA este creșterea cantității și
funcției CFTR-F508del la nivelul suprafeței celulei, ceea ce are ca rezultat o creștere a activității
CFTR.Acest efect a fost demonstrat în cadrul unor studii clinice care au stat la baza aprobării de către
Agenția Europeană a Medicamentului a acestui medicament pentru fibroza chistică / mucoviscidoză.
Ca toate medicamentele, acest medicament poate provoca reacții adverse.
Reacții adverse foarte frecvente (pot afecta mai mult de o persoană din 10): infecție a tractului respirator
superior, rinofaringită, cefalee, amețeală, durere orofariangiană, congestie nazală, diaree, durere
abdominală, creșteri ale valorilor transaminazelor, erupție cutanată tranzitorie, prezența de bacterii în spută
Reacții adverse frecvente (pot afecta mai puțin de 1 persoană din 10): rinită, otalgie, tinnitus, congestie
timpanică, tulburări vestibulare , congestie sinuzală, hiperemie faringiană, greață, formațiuni la nivelul
sânilor,hipoglicemie,durere abdominală în etajul superior,flatulență, acnee, prurit, creatinfosfokinază
sanguină crescută.
Reacții adverse mai rar întâlnite: hiperemia timpanului, inflamație de glandă mamară (mastita), durere sau
inflamație la nivelul mamelonului, wheezing, creștere tensiune arterială.
Tratamentul cu Kaftrio nu este indicat la copii cu vârsta sub 12 ani , dacă pacientul este alergic la Kaftrio
sau la oricare dintre celelalte componente ale acestui medicament sau dacă pacientul primește tratament cu
rifampicina, fenobarbital, carbamazepina, fenitoina.
Kaftrio poate afecta modul de acțiune al altor medicamente.
Spuneți medicului dumneavoastră dacă dumneavoastră (dacă sunteți pacient) sau copilul dumneavoastră
(dacă sunteți părinte de pacient) primiți sau s-ar putea să primiți alte medicamente concomitent cu Kaftrio.
Spuneți medicului dacă primiți dvs sau copilul dvs (ca pacient) oricare dintre următoarele medicamente:

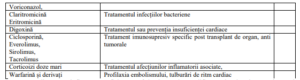
Aceste medicamente influențează eficiența Kaftrio și necesită modificarea dozelor și respectiv monitorizare
specială.
Se recomandă a se efectua analize ale sângelui înainte de tratamentul cu Kaftrio și periodic în timpul
tratamentului. Dacă pacientul are orice afecțiune hepatică sau renală, medicul trebuie să verifice periodic
funcțiile hepatice și renale, funcția pulmonară și afectarea oftalmologică (după un plan de monitorizare).
Pentru o supraveghere atentă a stării de sănătate a copilului aflat în tratament, a
eficienței și a posibilelor reacții adverse ale terapiei cu KAFTRIO, am obligația de a mă prezenta la medicul
curant pentru control la 1 lună, apoi la 3, 6,9, 12 luni de la inițierea tratamentului și ulterior anual în Centru
de Fibroză chistică și să respect protocolul de tratament și supraveghere, așa cum a fost publicat și explicat
mie de către medic, sau ori de câte ori apar modificări în evoluția stării de sănătate a copilului meu (dacă
sunt părinte/tutore legal) sau a mea (dacă sunt pacient), sau la solicitarea medicului curant sau a medicului
coordonator din Centrul de fibroză chistică.
În situația în care în mod nejustificat nu voi respecta obligațiile asumate, inclusiv cea de a mă prezenta
sistematic la controalele periodice stabilite prin protocolul terapeutic pentru fibroza chistică, care mi-au fost
comunicate de către medicul curant sau medicul coordonator din Centrul de Fibroză chistică, aceștia au
dreptul de a exclude copilul meu din acest program de tratament, așa cum este stipulat în protocolul
terapeutic.
În cazul în care evoluția clinică este nefavorabilă sau nu se îndeplinesc criteriile de eficiență, medicul
curant, împreună cu medicul coordonator pot opta pentru întreruperea tratamentului cu Kaftrio.
Sunt de acord să respect condițiile de includere în programul de tratament cu Kaftrio.
Înainte de a începe tratamentul, mă voi prezenta împreună cu copilul meu la
medicul curant în vederea instructajului efectuat de medic și de către asistenta medicală
privind modul de administrare.
Dupa initierea tratamentului in Centrul de Fibroza chistica, in termen de maxim 14 zile ma oblig sa ma
prezint cu toate documentele medicale la medicul din teritoriu care urmeaza a continua prescrierea
tratamentului (medicii din specialitatea pediatrie, pneumologie pediatrică, pneumologie din teritoriu sau
medicul meu de familie) și la Casa de Asigurări de Sănătate teritorială.
Pacient
Semnătura:
Părinte/ Tutore legal:
Semnătura:
Medic curant:
Semnătură:
Medic coordonator Centru :
Semnătură:
Data”
Cele mai noi stiri medicale:










