Protocol terapeutic
conform ordin MS/CNAS NR 702/133/2022
R07AX30 – DCI LUMACAFTORUM+IVACAFTORUM
R07AX30 – DCI LUMACAFTORUM+IVACAFTORUM
Citeste mai mult: https://www.formaremedicala.ro/r07ax30-dci-lumacaftorumivacaftorum/
I. INDICAȚII TERAPEUTICE
Lumacaftor/Ivacaftor (Orkambi) comprimate este indicat pentru tratamentul pacienților cu fibroză
chistică (FC), cu vârsta de 6 ani și peste, cu genotip homozigot pentru mutația F508del la nivelul
genei CFTR.
II. CRITERII DE INCLUDERE
• Pacienții diagnosticați cu fibroză chistică având genotip homozigot pentru mutația F508 prin
test genetic
• Testul sudorii la începerea tratamentului (nu este obligatoriu)
• Vârsta de 6 ani și peste
• Consimțământ informat: tratamentul va fi început numai după ce pacienții sau părinții,
respectiv tutorii legali ai acestora au semnat consimțământul informat privind administrarea
medicamentului, acceptarea criteriilor de includere, de excludere și de oprire a
tratamentului, precum și acceptul de a se prezenta periodic la evaluările recomandate.
III. CRITERII DE EXCLUDERE
• Vârsta sub 6 ani
• Pacienții cu fibroză chistică și genotip heterozigot F508
• Refuzul semnării consimțământului informat privind administrarea medicamentului, a
criteriilor de includere, excludere respectiv de oprire a tratamentului precum și acceptul de a
se prezenta periodic la evaluările recomandate.
• Pacienții cu intoleranță la galactoză, cu deficit total de lactază sau cei cu sindrom de
malabsorbție la glucoză-galactoză (pentru componenta de ivacaftor)
IV. CRITERII DE OPRIRE A TRATAMENTULUI
1. Efecte adverse respiratorii severe (bronhospasm, dispnee, scăderea marcată a FEV1 față
de valoarea inițială)
2. Pacient necompliant la evaluările periodice
3. Renunțarea la tratament din partea pacientului
4. Întreruperea din cauza reacțiilor adverse (altele decât cele respiratorii)
5. Creșteri semnificative ale transaminazelor (de exemplu, pacienții cu ALT sau AST ce cresc
de mai mult de 5 ori peste limita superioară a normalului [LSN] sau ALT ori AST ce cresc
de mai mult de 3 ori peste LSN și sunt asociate cu bilirubină ce crește de mai mult de 2 ori
peste LSN). In aceste cazuri administrarea dozelor trebuie întreruptă până la normalizarea
valorilor paraclinice observate. Ulterior va fi evaluat raportul intre beneficiile expectate și
riscurile posibile ale reluării tratamentului și se vor lua decizii conforme cu acest raport
risc/beneficiu.
V. DOZE ȘI MOD DE ADMINISTRARE
Lumacaftor/ivacaftor se poate iniția doar de către medicii care își desfășoară activitatea in centre
destinate evaluării si tratamentului fibrozei chistice și doar la pacienții cu genotip homozigot
2
DF508. Dacă genotipul pacientului nu este cunoscut, înainte de începerea tratamentului trebuie
aplicată o metodă de genotipare precisă și validată, pentru a confirma prezența acestui genotip.

Administrare:
Medicația trebuie administrată sincron cu alimente având un conținut lipidic, la o masă sau o
gustare la care se asociază enzime pancreatice.
Comprimate: Pacienții trebuie instruiți să înghită comprimatele întregi. Comprimatele nu trebuie
mestecate, zdrobite sau sparte înainte de ingerare.
Nu se administrează cu suc de grepfruit sau de portocale roșii, ceai de sunătoare.
Atenționări și precauții speciale:
Dacă pacientul uită să ia o doză, o poate primi în interval de 6 ore de la momentul uzual în care
primea respectiva doză și ar putea sa primească doza următoare conform orei prescrise anterior.
Dacă pacientul pierde o doză în interval mai mare de 6 ore va primi doar doza următoare.
Dozele de Lumacaftor/Ivacaftor pot fi modificate în cazul asocierii cu medicamente inhibitoare
CYP3A și la pacienții cu afectare hepatică sau renală semnificativă.
În eventualitatea unei creșteri semnificative a transaminazelor (de exemplu, pacienții cu ALT sau
AST ce cresc de mai mult de 5 ori peste limita superioară a normalului [LSN] sau ALT ori AST ce
cresc de mai mult de 3 ori peste LSN si sunt asociate cu bilirubină ce creste de mai mult de 2 ori
peste LSN), administrarea dozelor trebuie întreruptă și trebuie să se urmărească atent rezultatele
analizelor de laborator până la rezolvarea anomaliilor. După rezolvarea creșterilor transaminazelor,
trebuie să fie evaluat raportul risc/beneficiu al reluării tratamentului.
Tabel 1. Recomandări privind ajustarea dozei la pacienții cu afectare hepatică
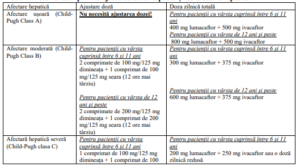

Administrarea nu este recomandată la pacienții cu insuficiență hepatică severă, decât dacă se
anticipează că beneficiile vor depăși riscurile.
Reacții adverse respiratorii
Reacțiile adverse respiratorii (disconfortul la nivelul toracelui, dispneea, bronhospasmul și respirația
anormală) au fost mai frecvente în timpul inițierii terapiei cu lumacaftor/ivacaftor. Evenimentele
respiratorii grave au fost observate mai frecvent la pacienții cu afectare respiratorie severă.
Experiența clinică la pacienții cu FEV1 < 40 % este limitată și se recomandă monitorizarea
suplimentară a acestor pacienți în timpul inițierii terapiei. Nu există experiență privind inițierea
tratamentului cu lumacaftor/ivacaftor la pacienții care manifestă o exacerbare pulmonară și, ca
atare, inițierea tratamentului la pacienții care manifestă o exacerbare pulmonară, la acel moment, nu
este recomandabilă.
Efect asupra tensiunii arteriale
S-a observat creșterea tensiunii arteriale la unii pacienți tratați cu lumacaftor/ivacaftor. Tensiunea
arterială trebuie monitorizată periodic, la toți pacienții, pe durata tratamentului.
Se recomandă prudență la pacienții cu insuficiență renală severă (clearance creatinină < 30 mL/min)
sau cu boală renală în stadiul terminal.
Tabel 2. Interacțiuni medicamentoase
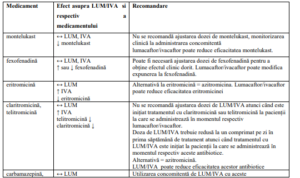
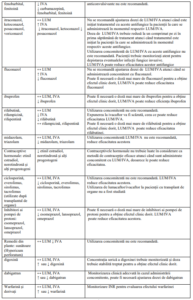
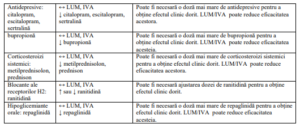
Notă: ↑ = creștere, ↓ = scădere, ↔ = nicio modificare; LUM = lumacaftor; IVA = ivacaftor.
Notă : studiile despre interacțiunile medicamentoase s-au efectuat doar la pacienții adulți.
Cât privește sarcina și alăptarea nu există date suficiente.
Poate produce amețeală, deci este necesară prudență în timpul condusului la acești pacienți.
VI. MONITORIZAREA PACIENȚILOR ÎN CADRUL PROGRAMULUI DE TRATAMENT
CU LUMACAFTOR/ IVACAFTOR
La includerea în tratamentul cu LUMACAFTOR/IVACAFTOR se documentează în dosarul
pacientului:
• Rezultatul analizei genetice care confirmă prezența genotipului homozigot DF508
• Evaluarea clinică conform Fișei de evaluare clinică inițială (anexa 1)
• Consimțământul informat al pacientului (reprezentant legal) (anexa 4)
Monitorizarea pacientului pe parcursul tratamentului cu Lumacaftor/Ivacaftor:
• Evaluarea la inițierea tratamentului (anexa 1)
• Monitorizarea inițierii tratamentului (anexa 2)
• Evaluarea la fiecare 3 luni de la inițierea tratamentului in primul an si apoi anual (anexa 3)
Monitorizarea tratamentului cu Lumacaftor/Ivacaftor după primul an de la inițierea acestuia se va
face anual conform fișei de monitorizare- (anexa 3). Monitorizarea pacientului în tratament
cu Lumacaftor/Ivacaftor va fi personalizată (ca interval de monitorizare) în funcție de gradul de
afectare hepatică/renală și de complicațiile bolii de fond.
Anexa 1 și Anexa 3 vor fi transmise de Centrele de Fibroză chistică/mucoviscidoză la CNAS în
vederea luării în evidență a pacienților sau excluderii acestora din evidență, după caz.
VII. PRESCRIPTORI:
Medici din specialitatea pediatrie, pneumologie pediatrică, pneumologie, cu experiență în
diagnosticul și tratamentul fibrozei chistice, care vor întocmi dosarul de inițiere al tratamentului și
vor emite prima prescripție medicală pentru o perioadă de 28 zile de tratament (menționăm că
deoarece cutia asigură tratamentul pentru 28 de zile, rețeta va fi eliberată separat de celelalte
medicamente cuprinse în Programul curativ 6.4 Mucoviscidoză care sunt recomandate pe o durata
diferită de timp).
6
Este recomandat ca medicii care initiaza tratamentul să facă parte din unul din Centrele Regionale
de fibroză chistică unde se pot asigura condițiile necesare monitorizării adecvate pentru acești
pacienți.
După inițierea tratamentului, continuarea prescrierii acestuia se poate face de către medicii din
specialitatea pediatrie, pneumologie pediatrică, pneumologie, din teritoriu sau de către medicul de
familie în baza scrisorii medicale din Centrul de fibroză chistică.
Recomandarea pentru inițierea tratamentului se face după evaluarea pacientului și a dosarului
acestuia și după confirmarea diagnosticului. Se menționează perioada pentru care va fi prescris
tratamentul (care nu va fi mai mare de 6 luni în primul an de tratament și 12 luni ulterior, cu
reevaluare în vederea continuării).
DOSARUL DE INIȚIERE A TRATAMENTULUI trebuie să cuprindă următoarele documente:
1. Datele de identificare (copii după certificat de naștere, carte de identitate)
2. Consimțământul informat al părintelui (tutorelui legal), al copilului, sau al bolnavului (dacă
are vârsta peste 18 ani) (anexa 4)
3. Bilet de externare sau scrisoare medicală dintr-un Centru de Fibroză Chistică care să ateste
diagnosticul de fibroză chistică/mucoviscidoză
4. Buletin de testare genetică care să ateste genotip homozigot F508
5. Evaluarea inițială – clinică și paraclinică (anexa 1)
6. Monitorizarea inițierii tratamentului (anexa 2)
7. Tratament concomitent (care ar impune modificarea dozelor terapeutice)
Anexa 1
Centrul de Fibroză chistică/mucoviscidoză
……………………………………………………………………….
Fișa de evaluare inițială în vederea includerii în tratament cu Lumacaftor/Ivacaftor


SE RECOMANDĂ:
Lumacaftor/Ivacaftor – doza:…………………….
Perioada…………………..
Medic :
Semnătura, parafă:
Data completării Fișei de inițiere:
Anexa 2
Centrul de Fibroză chistică/mucoviscidoză
……………………………………………………………………….
Fișa de monitorizarea a inițierii tratamentului cu Lumacaftor/Ivacaftor

Anexa 3
Fișa de monitorizare a pacientului cu Fibroză în tratament cu Lumicaftor/Ivacaftor
Centrul de Fibroză chistică/mucoviscidoză
……………………………………………………………………….
Tip evaluare
[ ] 3 luni; [ ] 6 luni; [ ] 9 luni; [ ]12 luni;
Anul inițierii tratamentului cu Lumacaftor/Ivacaftor:…….

SE RECOMANDĂ:
� Continuarea tratamentului cu Lumacaftor/Ivacaftor
– forma farmaceutică…………………………..
– doza: ………………. perioada……………….
� Întreruperea tratamentului cu Lumicaftor/Ivacaftor
Motivele care au dus la întreruperea tratamentului :
Medic centru de expertiză :
Semnătură, parafă:
Data completării Fișei de monitorizare:
Anexa 4
FORMULAR PENTRU CONSIMȚĂMÂNTUL PACIENTULUI CU FIBROZĂ CHISTICĂ
ELIGIBIL PENTRU TRATAMENT CU LUMACAFTOR/ IVACAFTOR
Subsemnatul(a) ……………………………….………………………………, cu CI/BI
……………………….
pacient/părinte/tutore legal al copilului
……………………………………………………………………………………..
cu CNP ………………………… diagnosticat cu fibroză chistică, homozigot F508del (pacient
adult/copil care îndeplinește criteriile de includere) am fost informat de către
………………………………………………………………….……… privind tratamentul medical al
bolii cu Lumacaftor/Ivacaftor (Orkambi).
Orkambi este un medicament care conține următoarele subtanțe active: lumacaftor și ivacaftor.
Lumacaftor/Ivacaftor (Orkambi) comprimate este indicat pentru tratamentul pacienților cu fibroză
chistică (FC), cu vârsta de 6 ani și peste, cu genotip homozigot pentru mutația F508del la nivelul
genei CFTR.
Ca toate medicamentele, acest medicament poate provoca reacții adverse.
Reacții adverse foarte frecvente (pot afecta mai mult de o persoană din 10): infecții de căi
respiratorii superioare, rinofaringită, cefalee, amețeală, congestie nazală, dispnee, tuse productivă,
creșterea producției de spută, dureri abdominale, diaree, greață, suprainfecții bacteriene.
Reacții adverse frecvente (pot afecta mai puțin de 1 persoană din 10): rinită, otalgie, tinitus,
congestie timpanică, tulburări vestibulare, odinofagie, congestie sinusală, hiperemie faringiană,
bronhospasm, flatulență, vărsături, creșteri ale valorilor transaminazelor, erupție cutanată
tranzitorie, formațiuni la nivelul sânilor, menstruație neregulată, dismenoree, metroragie.
Reacții adverse mai rar întâlnite: hipertensiune arterială, hepatită colestatică, encefalopatie
hepatică, congestie auriculară, menoragie, amenoree, polimenoree, oligomenoree, durere sau
inflamație la nivel mamelonar.
Tratamentul cu Orkambi nu este indicat la copii cu vârsta sub 6 ani, sau dacă pacientul este alergic
la Orkambi, sau la oricare dintre celelalte componente ale acestui medicament, sau dacă pacientul
primește tratament cu rifampicină, fenobarbital, carbamazepină, fenitoină.
Orkambi poate afecta modul de acțiune al altor medicamente!
Spuneți medicului dumneavoastră dacă dumneavoastră (în cazul că sunteți pacient) sau copilul
dumneavoastră (dacă sunteți părinte de pacient) primiți sau s-ar putea să primiți alte medicamente
concomitent cu Orkambi.
Spuneți medicului dacă primiți dvs. sau copilul dvs. (ca pacient) oricare dintre următoarele
medicamente:
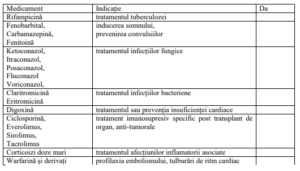
Aceste medicamente influențează eficiența Orkambi și necesită modificarea dozelor și respectiv
monitorizare specială.
Se recomandă a se efectua analize ale sângelui înainte de tratamentul cu Orkambi și periodic în
timpul tratamentului. Dacă pacientul are orice afecțiune hepatică sau renală, medicul trebuie să
verifice periodic funcțiile hepatice și renale, funcția pulmonară și afectarea oftalmologică conform
recomandarilor de monitorizare la 3, 6, 9 și 12 luni sau de câte ori consideră necesar în funcție de
evoluția pacientului.
Pentru o supraveghere atentă a stării de sănătate a copilului aflat în tratament, a
eficienței și a posibilelor reacții adverse ale terapiei cu Orkambi, am obligația de a mă prezenta la
medicul curant pentru control la 3, 6, 9, 12 luni de la inițierea tratamentului și ulterior anual, în
Centrul de Fibroză chistică și să respect protocolul de tratament și supraveghere, așa cum a fost
publicat și mi-a fost explicat de către medic, sau ori de câte ori apar modificări în evoluția stării de
sănătate a copilului meu (dacă sunt părinte/tutore legal) sau a mea (dacă sunt pacient), sau la
solicitarea medicului curant sau a medicului coordonator din Centrul de Fibroză chistică.
În situația în care în mod nejustificat nu voi respecta obligațiile asumate, inclusiv cea de a mă
prezenta sistematic la controalele periodice stabilite prin protocolul terapeutic pentru fibroza
chistică, obligații care mi-au fost comunicate de către medicul curant sau medicul coordonator din
Centrul de Fibroză chistică, aceștia au dreptul de a mă exclcude (sau a exclude copilul meu) din
acest program de tratament, așa cum este stipulat în protocolul terapeutic.
14
În cazul în care evoluția clinică este nefavorabilă sau riscurile prin efecte adverse depășesc
beneficiile, medicul curant împreună cu medicul coordonator pot opta pentru întreruperea
tratamentului cu Orkambi.
Sunt de acord să respect condițiile de includere în programul de tratament cu Orkambi.
Înainte de a începe tratamentul, mă voi prezenta împreună cu copilul meu la
medicul curant în vederea instructajului efectuat de către medic și de către asistenta medicală
privind modul de administrare.
După inițierea tratamentului în Centrul de Fibroză chistică, în termen de maxim 14 zile mă oblig să
mă prezint cu toate documentele medicale la medicul din teritoriu care urmează a continua
prescrierea tratamentului (medicii din specialitatea pediatrie, pneumologie pediatrică, pneumologie
din teritoriu sau medicul meu de familie).
Pacient:
Semnătura:
Părinte/ Tutore legal:
Semnătura:
Medic curant:
Semnătură:
Medic coordonator Centru :
Semnătură:
Data:
”
Cele mai noi stiri medicale:










