Protocol terapeutic
conform ordin MS/CNAS NR 564/499/2021
R07AX02 – DCI IVACAFTORUM
R07AX02 – DCI IVACAFTORUM
Citeste mai mult: https://www.formaremedicala.ro/r07ax02-dci-ivacaftorum/
1. INDICAȚII TERAPEUTICE
Ivacaftor este indicat pentru tratamentul copiilor cu vârsta mai mare de 12 luni si având
greutate mai mare de 7 kg cat si adolescenților și adulților cu fibroză chistică (FC)/
mucoviscidoză, care prezintă una dintre următoarele mutații de sincronizare (mutații de clasa III)
la nivelul genei CFTR: G551D, G1244E, G1349D, G178R, G551S, S1251N, S1255P, S549N
sau S549R .
Ivacaftor comprimate este de asemenea indicat pentru tratamentul pacienților adulți cu vârsta
de peste 18 ani, cu fibroză chistică (FC), care prezintă o mutație R117H a genei CFTR (vezi
specificații în tabel 1).
2. CRITERII DE INCLUDERE
• Pacienții diagnosticați cu fibroză chistică având una din mutațiile mai sus menționate
• Vârsta peste 12 luni și 7 kg pentru preparatul sub formă de granule
• Vârsta peste 6 ani si greutate de cel puțin 25 kg, adolescenți și adulți, pentru preparatul
sub formă de tablete
• Toți pacienții trebuie să efectueze testul sudorii cu maxim 6 luni anterior începerii
tratamentului
• Test genetic care să confirme prezența uneia din mutațiile menționate anterior
• Consimțământ informat: tratamentul va fi început numai după ce pacienții sau părinții
respectiv tutorii legali ai acestora au semnat consimțământul informat privind
administrarea medicamentului, acceptarea criteriilor de includere, de excludere și de
oprire a tratamentului, precum și acceptul de a se prezenta periodic la evaluările
recomandate.
3. CRITERII DE EXCLUDERE
• Vârsta sub 12 luni și greutatea sub 7 kg pentru preparatul granule
• Vârsta sub 6 ani și greutatea sub 25 kg pentru preparatul sub formă de tablete
• Pacienții cu fibroză chistică care nu prezintă una din mutațiile menționate anterior
• Refuzul semnării consimțământului informat privind administrarea medicamentului, a
criteriilor de includere, excludere respectiv de oprire a tratamentului precum și acceptul
de a se prezenta periodic la evaluările recomandate.
• Pacienții cu intoleranță la galactoză, cu deficit total de lactază sau cei cu sindrom de
malabsorbție la glucoză-galactoză
4. CRITERII DE OPRIRE A TRATAMENTULUI
Testul sudorii trebuie efectuat, la 6-8 săptămâni după începerea tratamentului, pentru a
determina reducerea valorii clorului sudoral ca indicator de eficiență și pentru verificarea
complianței la tratament. Testul sudorii se repetă la 6 luni de la începerea tratamentului și ulterior
anual la acei pacienți ce rămân in tratamentul cu Ivacaftor, pentru a documenta respectarea
acelorași cerințe de eficiență si complianță.
a) Absența eficienței tratamentului
Se consideră că tratamentul este eficient dacă :
– Valoarea obținută la Testul sudorii scade sub 60 mmol/l sau
– Valoarea obținută la Testul sudorii scade cu cel puțin 30% din valoarea inițială
Notă: în cazul în care testul sudorii inițial a fost borderline (valori peste limita normalului dar
sub 60 mmol/l) eficiența va fi demonstrată prin creșterea FEV1 cu cel puțin 5% din valoarea
preexistentă (la 1 lună anterior inițierii tratamentului) după 3 luni de la începerea acestuia, la
copilul care poate efectua spirometria.
Notă: în cazul în care scăderea valorii testului sudorii nu se evidențiază, se vor verifica inițial
complianța la tratament și corectitudinea recomandărilor (doze, mod de administrare, interval
timp, medicație concomitentă) si apoi se va repeta testul sudorii la 1 săptămână interval după
aceasta analiza, in vederea aprecierii eficientei.
b) Pacient necompliant la evaluările periodice
c) Renunțarea la tratament din partea pacientului
d) Întreruperea din cauza reacțiilor adverse
e) Creșteri semnificative ale transaminazelor (de exemplu, pacienții cu ALT sau AST ce cresc
de mai mult de 5 ori peste limita superioară a normalului [LSN] sau ALT ori AST ce cresc de mai
mult de 3 ori peste LSN si sunt asociate cu bilirubină ce creste de mai mult de 2 ori peste LSN).
In aceste cazuri administrarea dozelor trebuie întreruptă până la normalizarea valorilor
paraclinice observate. Ulterior va fi evaluat raportul intre beneficiile expectate și riscurile posibile
ale reluării tratamentului si se vor lua decizii conforme cu acest raport risc/beneficiu.
5. DOZE SI MOD DE ADMINISTRARE
Ivacaftor se poate iniția doar de către medicii care își desfășoară activitatea in centre destinate
evaluării si tratamentului fibrozei chistice și doar la pacienții cu mutațiile descrise anterior. Dacă
genotipul pacientului nu este cunoscut, înainte de începerea tratamentului trebuie aplicată o
metodă de genotipare precisă și validată, pentru a confirma prezența uneia din mutațiile indicate
in criteriile de includere.
• Pentru cazurile ce prezinta varianta poli-T (5T sau 7T dar si nu 9T) identificate in
asociere cu mutația R117H la adolescenții aflați la vârstă postpubertală va fi inițiată
terapia doar daca aceștia prezintă manifestări clinice fenotipice de fibroza chistică sau
daca este evidențiata anomalia de funcție a CFTR.
Ivacaftor în monoterapie:
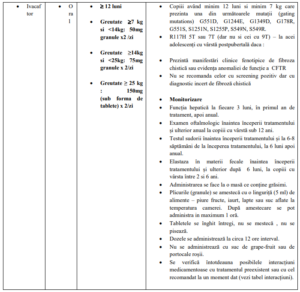
Pacienții cu vârsta de cel puțin 6 luni – forma granule

Pacienții cu vârsta de >6 ani și cu greutate >25 kg, un comprimat de 150 mg pe cale orală la
interval de 12 ore (doza zilnică totală este de 300 mg).
Administrare:
Ivacaftor trebuie administrat sincron cu alimente având un conținut lipidic, la o masă sau gustare
la care se asociază enzime pancreatice .
Comprimate: Pacienții trebuie instruiți să înghită comprimatele întregi. Comprimatele nu trebuie
mestecate, zdrobite sau sparte înainte de ingerare.
Granule in plic: Fiecare plic este numai pentru folosință unică și trebuie amestecat cu 5 ml de
alimente sau lichide adecvate vârstei (piure de fructe, iaurt, lapte). Trebuie consumat integral,
preferabil imediat amestecării cu produsul alimentar utilizat ca vehicul pentru medicație. În cazul
în care nu se consumă imediat, amestecul este stabil timp de o oră. Alimentele sau lichidul
utilizate ca vehicul trebuie să fie la o temperatura având valori cel mult egale cu temperatura
camerei; nu este permisa amestecarea cu lichide foarte fierbinți.
Nu se administrează cu suc de grape-fruit sau de portocale roșii.
Contraindicații: Ivacaftor nu se administrează la pacienți cu hipersensibilitate la
substanța activă sau la oricare dintre excipienți, la pacienți cu unele afecțiuni ereditare rare (de
tipul intoleranței la galactoză, deficit total de lactază, sau la aceia care prezinta sindrom de
malabsorbție de glucoză sau galactoză).
Administrarea Ivacaftor- tabel 1
Atenționări și precauții speciale:
Dacă pacientul uită să ia o doză, o poate primi în interval de 6 ore de la momentul uzual
în care primea respectiva doză și ar putea sa primească doza următoare conform orei prescrise
anterior. Dacă pacientul pierde o doză în interval mai mare de 6 ore va primi doar doza
următoare.
Dozele de Ivacaftor pot fi modificate în cazul asocierii cu medicamente inhibitoare
CYP3A și la pacienții cu afectare hepatica sau renală semnificativă.
În eventualitatea unei creșteri semnificative a transaminazelor (de exemplu, pacienții cu ALT sau
AST ce cresc de mai mult de 5 ori peste limita superioară a normalului [LSN] sau ALT ori AST
ce cresc de mai mult de 3 ori peste LSN si sunt asociate cu bilirubină ce creste de mai mult de 2
ori peste LSN), administrarea dozelor trebuie întreruptă și trebuie să se urmărească atent
rezultatele analizelor de laborator până la rezolvarea anomaliilor. După rezolvarea creșterilor
transaminazelor, trebuie să fie evaluat raportul risc/beneficiu al reluării tratamentului.

Administrarea nu este recomandată la pacienții cu insuficiență hepatică severă, decât dacă
se anticipează că beneficiile vor depăși riscurile.
Se recomandă prudență la pacienții cu insuficiență renală severă (clearance creatinină < 30
mL/min) sau cu boală renală în stadiul terminal.
Interacțiuni medicamentoase
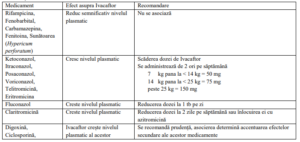
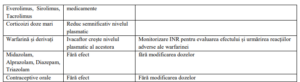
Notă : studiile despre interacțiunile medicamentoase s-au efectuat doar la pacienții adulți.
Cat privesc sarcina și alăptarea nu există date suficiente.
Poate produce amețeală, deci este necesara prudența în timpul condusului.
VI. MONITORIZAREA PACIENȚILOR ÎN CADRUL PROGRAMULUI DE
TRATAMENT CU IVACAFTOR
La includerea în Programul de tratament cu IVACAFTOR se documentează
în dosarul pacientului:
• Rezultatul analizei genetice care confirmă prezența a cel puțin una din mutațiile pentru
care este indicat medicamentul
• Evaluare clinică conform Fișei de evaluare clinică inițială (anexa 1)
Monitorizarea pacientului pe parcursul tratamentului cu Ivacaftor:
• Evaluarea eficienței tratamentului:
1. Efectuarea testului sudorii la 6-8 săptămâni de tratament sau
2. Efectuarea probelor funcționale respiratorii la pacientul cu vârstă peste 6 ani și testul
sudorii inițial sub 60 mmol/l
• Luna a 3-a de la inițierea tratamentului ( anexa 2) plus:
1. Spirometria la pacientul cu vârstă peste 6 ani și testul sudorii inițial sub 60 mmol/l
2. Evaluarea complianței la tratament, verificarea modului de administrare a tratamentului si
al medicației concomitente ce poate interfera cu acțiunea Ivacaftor.
• Luna a 6-a și a 12-a din primul an de la inițierea tratamentului – reevaluare într-unul
din Centrele de Fibroză chistică/mucoviscidoză – anexa 2.
Monitorizarea tratamentului cu Ivacaftor după primul an de la inițierea acestuia se va face anual
conform fisei de monitorizare.
Monitorizarea pacientului în tratament cu Ivacaftor va fi personalizată (ca interval de
monitorizare) în funcție de gradul de afectare hepatică/renală si de complicațiile bolii de fond.
Anexa 1 și anexa 2 vor fi transmise de Centrele de Fibroză chistică/mucoviscidoză la CNAS în
vederea luării în evidență a pacienților sau excluderii acestora din evidență, după caz.
VII. PRESCRIPTORI:
Medici din specialitatea pediatrie, pneumologie pediatrică, pneumologie, cu experiență în
diagnosticul și tratamentul fibrozei chistice, care vor întocmi dosarul de inițiere al tratamentului
si vor emite prima prescripție medicala pentru o perioada de maxim 30/31 zile de tratament. Este
recomandat ca medicii prescriptori să facă parte din unul din Centrele Regionale de fibroză
chistică unde se pot asigura condițiile necesare monitorizării adecvate pentru acești pacienți.
După inițierea tratamentului, continuarea acestuia se poate face de medicii din specialitatea
pediatrie, pneumologie pediatrică, pneumologie din teritoriu sau de către medicul de familie în
baza scrisorii medicale sau a biletului de ieșire de la medicul coordonator.
Recomandarea pentru inițierea tratamentului se face după evaluarea pacientului și a dosarului
acestuia și după confirmarea diagnosticului. Se menționează perioada pentru care va fi prescris
tratamentul (care nu va fi mai mare de 6 luni în primul an de tratament si 12 luni ulterior , cu
reevaluare în vederea continuării).
DOSARUL DE INIȚIERE A TRATAMENTULUI trebuie să cuprindă următoarele
documente:
1. Datele de identificare (copii după certificat de naștere, carte de identitate);
2. Referat de justificare, parafat și semnat de medicul specialist/primar
pediatru / pneumolog / pneumolog pediatru.
3. Consimțământul informat al părintelui (tutorelui legal) al copilului sau al
bolnavului (dacă are vârsta peste 18 ani) (anexa 3 a prezentului protocol); A fost completat
consimțământul de la părinți și/sau pacient pentru acord privind administrarea:
�DA�NU
4. Bilet de externare sau scrisoare medicală dintr-un Centru de Fibroză Chistică care să ateste
diagnosticul de fibroză chistică / mucoviscidoză.
5. Buletin de testare genetică care să ateste diagnosticul de fibroză chistică cu minim o mutație
specificată în indicațiile terapeutice ale preparatului, semnat și parafat de un medic specialist /
primar genetician;
6. Evaluarea inițială – clinică și paraclinică (anexa 1 a prezentului protocol);
7. Tratament concomitent (care ar impune modificarea dozelor terapeutice).
Anexa 1
Centrul de Fibroză chistică /mucoviscidoză
……………………………………………………………………….
Fișa de evaluare inițială în vederea includerii în tratament cu Ivacaftor a
pacientului cu Fibroză chistică/mucoviscidoză
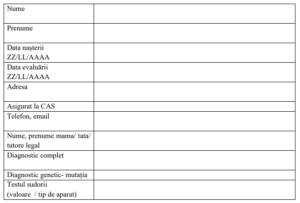


Anexa 2
Fișa de monitorizare a pacientului cu Fibroză chistică/mucoviscidoză în tratament cu
Ivacaftor
Centrul de Fibroză chistică/mucoviscidoză
……………………………………………………………………….
Tip evaluare
[ ] 6 luni; [ ]12 luni;
Anul inițierii tratamentului cu Ivacaftor

*la 6 luni de la inițiere și ulterior anual
**la 6 luni de la inițiere până la 6 ani
***la inițiere și apoi anual la pacientul cu vârstă mai mică de 18 ani
# la 6 luni de la inițierea tratamentului și ulterior anual. La pacientul care are afectare hepatică – la 3 luni
SE RECOMANDĂ:
_ _ Continuarea tratamentului cu Ivacaftor – forma farmaceutică…………………………..
doza: ………………. perioada……………….
_ _ Întreruperea tratamentului cu Ivacaftor
Medic centru de expertiză :
Semnătură, parafă:
Data completării Fișei de monitorizare:
Anexa 3
FORMULAR PENTRU CONSIMȚĂMÂNTUL PACIENTULUI CU FIBROZA
CHISTICĂ ELIGIBIL PENTRU TRATAMENT CU IVACAFTOR
Subsemnatul(a) …………………………………………..……………………………………………, cu
CI/BI
…………………………..……………….. pacient /părinte/tutore legal al copilului
………………………………………………………………………………. cu CNP
……………………… diagnosticat cu fibroză chistică și cu minim o mutație (G551D, G1244E,
G1349D, G178R, G551S, S1251N, S1255P, S549N sau S549R sau R117H – pacient adult care
îndeplinește criteriile de includere) am fost informat de către
………………………………………… privind tratamentul medical al bolii cu Ivacaftor
(Kaydeco).
Kalydeco este un medicament care conține substanța activă Ivacaftor. Ivacaftor este disponibil
sub formă comprimate filmate de 150 mg și plicuri de 25 mg, 50 mg sau 75 mg Ivacaftor.
Ivacaftor se utilizează în tratamentul pacienților cu fibroză chistică cu vârste de peste 12 luni și
adulți care au una din mutațiile descrise anterior și care modifică transportul normal al clorului și
respectiv al sodiului la nivelul canalelor specifice (potențiator).
Acest efect a fost demonstrat în cadrul unor studii clinice care au stat la baza aprobării Ivacaftor
de către Agenția Europeană a Medicamentului pentru fibroza chistică / mucoviscidoză.
• Ca toate medicamentele, acest medicament poate provoca reacții adverse.
Reacții adverse foarte frecvente (pot afecta mai mult de o persoană din 10): infecții căi
respiratorii superioare, rinofaringită, cefalee, amețeală, odinofagie, congestie nazală, dureri
abdominale, diaree, creșterea transaminazelor, erupție cutanata, suprainfecții bacteriene.
• Reacții adverse frecvente (pot afecta mai puțin de 1 persoană din 10): rinită, otalgie, tinnitus,
congestie timpanică, tulburări vestibulare , congestie sinuzală, hiperemie faringiană, greață,
formațiuni la nivelul sânilor.
• Reacții adverse mai rar întâlnite: hiperemia timpanului, inflamație de glandă mamară
(mastita), durere sau inflamație la nivelul mamelonului.
• Tratamentul cu Ivacaftor (Kalydeco) nu este indicat la copii cu vârsta sub 12 luni , dacă
pacientul este alergic la Ivacaftor sau la oricare dintre celelalte componente ale acestui
medicament sau dacă pacientul primește tratament cu rifampicina, fenobarbital,
carbamazepina, fenitoina.
• Ivacaftor poate afecta modul de acțiune al altor medicamente.
• Spuneți medicului dumneavoastră dacă dumneavoastră (dacă sunteți pacient) sau copilul
dumneavoastră (dacă sunteți părinte de pacient) primiți sau s-ar putea să primiți alte
medicamente concomitent cu Ivacaftor.
• Spuneți medicului dacă primiți dvs sau copilul dvs (ca pacient) oricare dintre următoarele
medicamente:
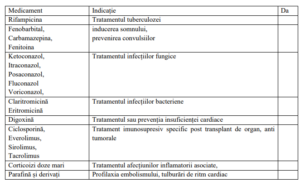
Aceste medicamente influențează eficiența Ivacaftor și necesită modificarea dozelor și respectiv
monitorizare specială.
Se recomandă a se efectua analize ale sângelui înainte de tratamentul cu Ivacaftor și periodic în
timpul tratamentului. Dacă pacientul are orice afecțiune hepatică sau renală, medicul trebuie să
verifice periodic funcțiile hepatice și renale, funcția pulmonară și afectarea oftalmologică (la 3
luni, 6 luni, la 12 luni și ulterior la 12 luni sau atunci când consideră necesar).
Pentru o supraveghere atentă a stării de sănătate a copilului aflat în tratament, a
eficienței și a posibilelor reacții adverse ale terapiei cu Ivacaftor, am obligația de a mă prezenta la
medicul curant pentru control la 6-8 săptămâni, apoi la 3, 6, 12 luni de la inițierea tratamentului și
ulterior anual în Centru de Fibroză chistică și să respect protocolul de tratament și supraveghere,
așa cum a fost publicat și explicat mie de către medic, sau ori de câte ori apar modificări în
evoluția stării de sănătate a copilului meu (dacă sunt părinte/tutore legal) sau a mea (dacă sunt
pacient), sau la solicitarea medicului curant sau a medicului coordonator din Centrul de fibroză
chistică.
În situația în care în mod nejustificat nu voi respecta obligațiile asumate, inclusiv cea de a mă
prezenta sistematic la controalele periodice stabilite prin protocolul terapeutic pentru fibroza
chistică, care mi-au fost comunicate de către medicul curant sau medicul coordonator din Centrul
de Fibroză chistică, aceștia au dreptul de a exclude copilul meu din acest program de tratament,
așa cum este stipulat în protocolul terapeutic.
În cazul în care evoluția clinică este nefavorabilă sau nu se îndeplinesc criteriile de eficiență,
medicul curant, împreună cu medicul coordonator pot opta pentru întreruperea tratamentului cu
Ivacaftor.
Sunt de acord să respect condițiile de includere în programul de tratament cu Ivacaftor.
Înainte de a începe tratamentul, mă voi prezenta împreună cu copilul meu la
medicul curant în vederea instructajului efectuat de medic și de către asistenta medicală
privind modul de administrare.
După inițierea tratamentului in Centrul de Fibroza chistica, in termen de maxim 14 zile mă oblig
sa mă prezint cu toate documentele medicale la medicul din teritoriu care urmează a continua
prescrierea tratamentului (medicii din specialitatea pediatrie, pneumologie pediatrică,
pneumologie din teritoriu sau medicul meu de familie).
Pacient
Semnătura:
Părinte/ Tutore legal:
Semnătura:
Medic curant:
Semnătură:
Medic coordonator Centru :
Semnătură:
Data :
Cele mai noi stiri medicale: