Protocol terapeutic
conform ordin MS/CNAS NR 564/499/2021
N07XX12 – DCI PATISIRANUM
N07XX12 – DCI PATISIRANUM
Citeste mai mult: https://www.formaremedicala.ro/n07xx12-dci-patisiranum/
BOALA: Amiloidoza mediată de transtiretină (amiloidoza hATTR)
• Aceasta este o boală multisistemică rară care apare la adulți, din cauze ereditare, autosomal
dominant, progresivă, care pune viața în pericol, cauzată de mutații ale codificării genei
transtiretina.
• Patogeneza amiloidozei mediată de transtiretină constă în mutații autosomal dominante în gena
care codifică transtiretina (TTR), o proteină formată din 127 aminoacizi, produsă preponderent de
hepatocite, cu o fracție minimă produsă de plexul coroid și retina. Transtiretina este o proteină
plasmatică tetramerică, transportoare pentru tiroxină și vitamina A.
• Amiloidoza hATTR este o boală progresivă și cu evoluție fatală, cu o multitudine de simptome, care
se poate manifesta prin neuropatie periferică (senzorială și motorie), neuropatie autonomă și / sau
cardiomiopatie. Polineuropatia datorată amiloidozei TTR este o neuropatie degenerativă, axonală,
progresivă. Vârsta de debut a simptomatologiei variază între a doua și a noua decadă a vieții.
• Speranța de viață este de obicei între 3 și 15 ani de la debutul simptomelor, în funcție de mutația
TTR și tabloul clinic. Pacienții cu afectare cardiacă au, de obicei, o speranță de viață mai scurtă, în
timp ce prognosticul este variabil în cazul paciențiilor cu polineuropatie.
I. Indicaţia:
• PATISIRANUM este indicat pentru tratamentul amiloidozei ereditare mediată de transtiretină
(amiloidoză hATTR) la pacienții adulți cu polineuropatie de stadiu 1 sau stadiu 2.
• PATISIRANUM este un acid ribonucleic interferent mic cu catenă dublă (siRNA), care țintește în
mod specific o secvență conservată genetic din regiunea 3′ fără translații a tuturor ARNm ai TTR cu
mutații și de tip sălbatic.
• PATISIRANUM este furnizat sub formă de nanoparticule lipidice, pentru a furniza siRNA în
hepatocite, sursa primară a proteinei TTR din circulație.
• Printr-un proces natural, numit interferența ARN (ARNi), PATISIRANUM provoacă degradarea
catalitică a ARNm al TTR la nivelul ficatului, ducând la o scădere a valorilor serice ale proteinei
TTR.
II. Criterii de includere pentru indicaţie
• Initierea tratamentului cu PATISIRANUM se va face dupa stabilirea cu certitudine a
diagnosticului in centre cu expertiza in managementul amiloidozei hATTR (neurologie sau/si
hematologie), prin examen clinic si de laborator (examenul neuroelectrofiziologic efectuat de
catre un medic neurolog care are competenta oficiala in acest domeniu de explorari, este
obligatoriu)
• Reducând concentrațiile serice de proteină TTR, tratamentul cu PATISIRANUM determină o
scădere a valorilor serice de vitamina A (retinol). Valorile serice de vitamina A sub limita inferioară
a normalului trebuie corectate și orice semne sau simptome oculare datorate deficienței de
vitamina A trebuie evaluate înainte de inițierea tratamentului cu PATISIRANUM.
• În timpul primelor 60 de zile de sarcină, atât valorile prea mari sau prea mici de vitamina A pot fi
asociate cu un risc crescut de malformații fetale. Prin urmare, trebuie exclusă sarcina înainte de a
iniția PATISIRANUM, iar femeile aflate la vârsta fertilă să utilizeze metode contraceptive eficace.
III. Tratament – Doze, condiţiile de scădere a dozelor:
Doza recomandată de PATISIRANUM este de 300 micrograme per kg greutate corporală, administrată
sub forma unei perfuzii intravenoase (i.v.) o dată la 3 săptămâni.
Doza se calculează în funcție de greutatea corporală efectivă. Pentru pacienții cu greutatea ≥ 100 kg,
doza maximă recomandată este de 30 mg.
Se recomandă suplimentarea vitaminei A cu aproximativ 2500 UI vitamina A pe zi la pacienții tratați cu
PATISIRANUM.
Premedicație necesară:
Tuturor pacienților trebuie să li se administreze premedicație înainte de administrarea PATISIRANUM
pentru a se reduce riscul de reacții asociate perfuziei (RAP). Trebuie administrat fiecare dintre
următoarele medicamente în ziua de administrare a perfuziei cu PATISIRANUM, cu cel puțin 60 minute
înainte de inițierea perfuziei:
• Corticosteroid intravenos (dexametazonă 10 mg sau echivalent)
• Paracetamol oral (500 mg)
• Blocant intravenos al H1 (difenhidramină 50 mg sau echivalent)
• Blocant intravenos al H2 (ranitidină 50 mg sau echivalent)
Pentru premedicațiile care nu sunt disponibile sau nu sunt tolerate pe cale intravenoasă, pot fi
administrate pe cale orală medicamente echivalente.
Dacă este indicat din punct de vedere clinic, doza de corticosteroid poate fi redusă în trepte de cel mult
2,5 mg, până la o doză minimă de 5 mg de dexametazonă (i.v.) sau echivalent. Înainte de fiecare
reducere a dozei de premedicație cu corticosteroid, pacientului trebuie să i se administreze cel puțin 3
perfuzii i.v. consecutive cu PATISIRANUM și să nu fie prezente RAP.
Dacă este necesar, pot fi administrate doze suplimentare sau mai crescute dintr-una sau mai multe
premedicații pentru a reduce riscul de RAP
Doză omisă
În cazul în care se omite o doză, PATISIRANUM trebuie administrat imediat ce este posibil. Dacă
PATISIRANUM este administrat în interval de 3 zile de la doza omisă, administrarea dozelor trebuie
continuată conform schemei inițiale de tratament a pacientului. Dacă PATISIRANUM este administrat
după mai mult de 3 zile de la doza omisă, administrarea dozelor trebuie continuată o dată la 3 săptămâni
ulterior
Mod de administrare
PATISIRANUM este destinat administrării intravenoase. PATISIRANUM trebuie diluat înainte de
administrarea perfuziei intravenoase
Trebuie utilizată o linie dedicată, cu un set de perfuzie care include un filtru de perfuzie încorporat din
polietersulfonă (PES) de 1,2 microni.
Seturile și liniile de perfuzie trebuie să nu conțină di(2-etilhexil)ftalat (DEHP).
Soluția diluată de PATISIRANUM trebuie perfuzată intravenos în decurs de aproximativ 80 minute, la o
viteză inițială a perfuziei de aproximativ 1 ml/minut în primele 15 minute, urmată de o creștere la
aproximativ 3 ml/min pentru partea rămasă din perfuzie. Durata perfuziei poate fi prelungită în cazul
unei RAP.
PATISIRANUM trebuie administrat numai printr-o linie venoasă de acces cu debit neobstrucționat.
Trebuie monitorizat locul perfuziei din punct de vedere al apariției posibile a infiltrației în timpul
administrării. Extravazarea suspectată trebuie abordată conform practicii standard pentru substanțe
nevezicante.
Pacientul trebuie ținut sub observație în timpul perfuziei și, dacă este indicat din punct de vedere clinic,
trebuie ținut sub observație și ulterior administrării perfuziei.
După încheierea perfuziei, în setul de administrare intravenoasă trebuie introdusă soluție de clorură de
sodiu 9 mg/ml (0,9%) pentru a se asigura faptul că s-a administrat întreaga cantitate de medicament.
Poate fi luată în considerare administrarea la domiciliu a perfuziei de PATISIRANUM pentru pacienții
care au tolerat bine cel puțin 3 perfuzii la clinică. Decizia ca pacientului să i se administreze perfuzii la
domiciliu trebuie luată în urma evaluării și recomandării de către medicul curant. Perfuziile la domiciliu
trebuie efectuate de un profesionist din domeniul sănătății.
Durata tratamentului:
• Tratamentul continuă la pacientii cu indicatia terapeutică până la toxicitate semnificativă sau
retragerea consimţământului. In studiile clinice care au dus la inregistrarea produsului s-a observat
dupa 9 luni de tratament cu PATISIRANUM oprirea sau inversarea progresiei bolii , semnificative
statistic. Aceste rezultate au fost confirmate si dupa 18 luni de tratament.
• Concentrația serică media a TTR a fost redusă cu aproximativ 80% în interval de 10 până la 14 zile
după administrarea unei doze unice de PATISIRANUM 300 micrograme/kg.; după doze repetate
administrate o dată la 3 săptămâni, reducerile medii ale concentrațiilor serice de TTR după 9 și 18
luni de tratament au fost de 83% și respectiv 84%.
• Reducerea concentrațiilor serice de TTR s-a menținut în cazul administrării continue.
IV. Criterii de excludere din tratament:
• Hipersensibilitate severă (de exemplu, anafilaxie) la substanța activă sau la oricare dintre
excipienții
• Siguranța și eficacitatea PATISIRANUM la copii și adolescenți cu vârsta < 18 ani nu au fost stabilite.
Nu sunt disponibile date.
V. Criterii de întrerupere a tratamentului (temporar/definitiv la latitudinea medicului curant):
• Dacă o femeie are intenția de a rămâne gravidă, administrarea PATISIRANUM și suplimentarea
vitaminei A trebuie întrerupte, iar valorile serice de vitamina A trebuie monitorizate și să fi revenit
la normal înainte să se încerce concepția.
• În eventualitatea unei sarcini neplanificate, PATISIRANUM trebuie întrerupt. Suplimentarea
vitaminei A trebuie întreruptă în primul trimestru, cu excepția situației în care femeia gravidă
prezintă semne de deficiență de vitamina A. Dacă sunt prezente astfel de semne, suplimentarea
vitaminei A nu trebuie să depășească 2500 UI pe zi. Ulterior, suplimentarea vitaminei A de 2500 UI
pe zi trebuie să fie reluată în al doilea și al treilea trimestru dacă valorile serice ale vitaminei A nu
au revenit la normal, din cauza riscului crescut de deficiență de vitamina A în trimestrul al treilea.
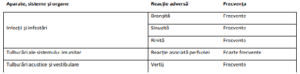
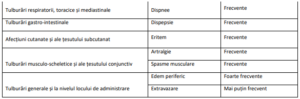
• La pacienții tratați cu PATISIRANUM s-au observat RAP. La pacienții care au manifestat RAP, prima
RAP a apărut la majoritatea la primele 2 perfuzii. În cadrul studiilor clinice, simptomele cele mai
frecvente (raportate la ≥ 2% dintre pacienți) ale RAP au fost înroșirea tegumentelor, dorsalgia,
greața, durerea abdominală, dispneea și cefaleea. Pentru a se reduce riscul de RAP, pacienților
trebuie să li se administreze premedicația în ziua de administrare a perfuziei de PATISIRANUM, cu
cel puțin 60 minute înainte de inițierea perfuziei.
• În cazul apariției unei RAP, trebuie luată în considerare încetinirea sau întreruperea perfuziei și
instituirea tratamentului medical (de exemplu, tratament cu corticosteroizi sau alt tratament
simptomatic), după cum este indicat din punct de vedere clinic. În cazul întreruperii perfuziei,
poate fi luată în considerare reluarea acesteia cu o viteză mai redusă a perfuziei după remiterea
simptomelor.
• Administrarea perfuziei de PATISIRANUM trebuie oprită în cazul unei RAP grave sau cu risc letal.
• Unii pacienți care manifestă RAP pot avea beneficii în urma unei viteze mai scăzute a perfuziei
sau a unor doze suplimentare sau mai crescute dintr-una sau mai multe premedicații, la
perfuziile ulterioare, pentru a reduce riscul de RAP.
• Reacțiile adverse care au apărut cel mai frecvent la pacienții tratați cu PATISIRANUM au fost
edemul periferic (29,7%) și reacțiile asociate perfuziei (18,9%). Singura reacție adversă care a dus
la întreruperea administrării de PATISIRANUM a fost o reacție asociată perfuziei (0,7%).
VI. Monitorizarea tratamentului (parametrii clinico-paraclinici şi periodicitate)
• Cel putin la 6 luni, medicul din teritoriu va trimite pacientul la control periodic pentru monitorizare
clinica (si, dupa caz si de de laborator), in clinica universitara unde s-a initiat acest tip de
tratament.
• In functie de rezultatele la controlul periodic, dupa cel putin 6 luni de tratament, in cazul
amiloidozei ereditare mediată de transtiretină la pacienții adulți cu polineuropatie de stadiu 1, un
pacient poate trece de la tafamidis la patisiranum si viceversa de la patisiranum la tafamidis,
numai pentru stadiul 1 de polineuropatie; tafamidis nu este indicat in cazul amiloidozei ereditare
mediată de transtiretină la pacienții adulți cu polineuropatie de stadiu 2.
VII Prescriptori
• Tratamentul trebuie inițiat sub supravegherea unui medic cu experiență în abordarea terapeutică
a amiloidozei, intr-o clinica universitara de Neurologie si/sau Hematologie, de catre un medic
neurolog sau hematolog.
• Tratamentul poate fi continuat si de către un medic primar/specialist neurolog sau hematolog
dintr-o unitate sanitara prin care se deruleaza programul, din zona teritorială în care locuieşte
bolnavul.
Cele mai noi stiri medicale: