Protocol terapeutic
conform ordin MS/CNAS NR 564/499/2021
M09AX10 – DCI RISDIPLAMUM
M09AX10 – DCI RISDIPLAMUM
Citeste mai mult: https://www.formaremedicala.ro/m09ax10-dci-risdiplamum/
Definiția afecțiunii
Atrofia musculară spinală (AMS) este o boală neuromusculară progresivă datorată unor
mutaţii la nivelul genei SMN1 din cromozomul 5q, genă ce codifică proteina SMN (survival
motor neuron). O a doua genă, SMN2, situată în apropierea SNM1, este responsabilă pentru o
mică parte din producţia de proteină SMN. AMS prezintă un spectru de manifestări clinice ale
bolii, severitatea mai mare a afecţiunii fiind corelată cu numărul mai mic de copii ale genei
SMN2 şi cu vârsta mai mică în momentul debutului simptomelor.
I. Indicație terapeutică
Risdiplam este indicat pentru tratamentul amiotrofiei spinale (atrofie musculară spinală,
AMS) 5q la pacienţi cu vârsta de 2 luni şi peste (minim 2 luni), cu un diagnostic clinic de
AMS tip 1, tip 2 sau tip 3, cu una până la patru copii ale genei SMN2.
II. Criterii pentru includerea unui pacient în tratament
Decizia de tratament trebuie să se bazeze pe o evaluare individualizată, realizată de un
specialist cu experienţă în managementul pacienţilor cu AMS, cu privire la beneficiile
tratamentului pentru pacienţi, în raport cu riscurile potenţiale ale tratamentului cu risdiplam.
Evaluarea clinică iniţială se va realiza în condiţii de stare stabilă a pacientului, fără afecţiuni
intercurente, pentru a reflecta corect situaţia funcţiei motorii şi respiratorii.
II.A. Criterii de includere în tratament
Pacienţi cu AMS Tip 1, Tip 2 si Tip 3
a. Obiectivele tratamentului
Creşterea duratei de supravieţuire şi a calităţii vieţii pacientului diagnosticat cu AMS, prin
îmbunătățirea/menţinerea funcţiei motorii şi ameliorarea funcţiei respiratorii, (evitarea
ventilaţiei asistate permanente sau prelungirea timpului până la apariţia necesităţii unei
ventilaţii asistate permanente).
b. Criterii de iniţiere a tratamentului
Se consideră eligibili pentru iniţierea tratamentului cu risdiplam pacienţii care îndeplinesc
cumulativ următoarele criterii:
• diagnostic clinic de AMS fenotipurile 1, 2 sau 3
• confirmarea genetica a bolii prin prezența unei mutaţii (deleţii) homozigote sau
heterozigote compusă a genei 5q SMN1.
• existenţa unui număr între 1 și 4 copii ale genei SMN2.
• pacienţi cu vârsta de doua luni și peste.
• existenta acordului informat al pacientului/ reprezentantilor lui legali
SAU UNUL DINTRE
• pacienți simptomatici care au fost inițiați pe tratamentul cu risdiplam în cadrul unor
programe de acces precoce la tratament sau programe de tratament de ultima instanta.
• pacienți care au beneficiat de alte tratamente pentru AMS, pe care medicul curant a
decis sa le întrerupă din motive medicale, documentate (de ex.: răspuns terapeutic
nesatisfacator, reactii adverse, condiții anatomice dificile). Pacienții care îndeplinesc
criteriile de initiere a tratamentului cu risdiplam cu întreruperea celui cu nusinersen,
din motive medicale, vor introduce tratamentul cu risdiplam ≥ 4 luni de la ultima
injectare cu nusinersen.
II.B. Criterii de excludere
Pacienţi cu AMS Tip 1, Tip 2, Tip 3
Nu se recomandă iniţierea tratamentului cu risdiplam în oricare din următoarele situaţii:
• pacienţi cu mai mult de 4 copii ale genei SMN2.
• pacienţi care în momentul inițierii necesită ventilaţie asistată (invazivă sau
noninvazivă) permanentă (>16 h/zi de ventilație continuă în ultimele >21 zile sau
traheostomie, care nu sunt urmare a unui episod acut reversibil) și nu au fost initiati în
cadrul unor programe de acces precoce sau programe de tratament de ultima instanță.
• hipersensibilitate cunoscută la substanța activă sau la oricare dintre excipienti.
• pacienti care au primit terapie genică sau care primesc tratament cu nusinersen.
III. Tratament
Risdiplam este un modificator al matisării ARN premesager ce codifică proteina SMN2
(survival of motor neuron 2), conceput pentru a trata AMS cauzată de mutaţiile genei SMN1
la nivelul cromozomului 5q, care duc la deficitul de proteină SMN.
Deficitul de proteină SMN funcţională este direct corelat cu fiziopatologia AMS, care implică
pierderea progresivă a neuronilor motori şi slăbiciune musculară. Risdiplam rectifică procesul
de asamblare a ARN pentru SMN.
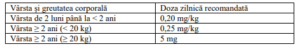
Doze şi algoritm de administrare
Doza de risdiplam recomandată pentru administrarea zilnică este stabilită în funcţie de vârstă
şi greutatea corporală.
Risdiplam se administrează pe cale orală, o dată pe zi, după masă, la aproximativ aceeaşi oră,
în fiecare zi.
Schema de administrare în funcţie de vârstă şi greutatea corporală
Vârsta şi greutatea corporală Doza zilnică recomandată
Mod de administrare
Administrare orală.
Înainte de eliberarea din circuitul medical, risdiplam trebuie reconstituit de către un
farmacist. Este recomandat ca medicul curant sau farmacistul să discute cu pacientul sau cu
persoana care îl îngrijeşte despre modul în care se pregăteşte doza zilnică prescrisă, înainte de
administrarea primei doze.
Risdiplam se administrează pe cale orală, o dată pe zi, după masă, la aproximativ aceeaşi oră
zilnic, cu ajutorul seringii reutilizabile furnizate pentru administrare orală. La sugarii care sunt
alăptați, risdiplam trebuie administrat după alăptare.
Risdiplam nu trebuie amestecat cu lapte sau formule de lapte.
Risdiplam trebuie administrat imediat după ce a fost extras în seringa pentru administrare
orală.
Dacă nu este administrat în interval de 5 minute, trebuie eliminat din seringă pentru
administrare orală şi pregătită o nouă doză.
Dacă soluţia de risdiplam se varsă sau ajunge în contact cu pielea, zona respectivă
trebuie spălată cu apă şi săpun.
Pacientul trebuie să bea apă după administrarea risdiplam, pentru a se asigura faptul că
medicamentul a fost înghiţit în întregime. Dacă pacientul nu poate înghiţi şi are montată o
sondă nazogastrică sau o gastrostomă in situ, risdiplam poate fi administrat prin tubul
respectiv. După administrarea risdiplam, tubul trebuie clătit cu apă.
Ajustarea dozei administrate
Omiterea sau întârzierea administrării dozelor
În cazul în care se omite o doză planificată, aceasta trebuie administrată cât mai curând
posibil, dacă au trecut mai puţin de 6 ore de la momentul programat pentru doza respectivă. În
caz contrar, nu se va mai utiliza doza omisă şi se va administra următoarea doză, la ora
programată obişnuită din ziua următoare.
Dacă o doză nu este înghiţită în întregime sau apar vărsături după administrarea unei
doze de risdiplam, nu trebuie administrată o altă doză pentru a compensa doza
incompletă. Doza următoare trebuie administrată la ora programată obişnuită.
Vârstnici
Pe baza datelor limitate provenite de la subiecţi cu vârsta de 65 de ani şi peste, nu este
necesară ajustarea dozei la pacienţii vârstnici.
Insuficienţă renală
Risdiplam nu a fost studiat la această categorie de pacienţi. Nu se anticipează necesitatea
ajustării dozei la pacienții cu insuficienţă renală.
Insuficiență hepatică
Nu este necesară ajustarea dozei la pacienţii cu insuficienţă hepatică uşoară sau moderată.
Pacienţii cu insuficienţă hepatică severă nu au fost investigaţi şi pot prezenta un nivel crescut
de expunere la risdiplam.
Sugari
Siguranţa şi eficacitatea risdiplam la copii cu vârsta sub 2 luni nu au fost încă stabilite. Nu
sunt disponibile date.
Notă: Pacienţii trataţi cu risdiplam vor primi concomitent îngrijiri conform Declaraţiei de
Consens pentru tratamentul standardizat acordate pacienţilor cu Atrofie Musculară Spinală
(vaccinuri, profilaxia infecţiilor cu virus sinciţial respirator, aport nutriţional adecvat, suport
respirator la nevoie, kinetoterapie etc).
IV. Contraindicatii
Hipersensibilitate la substanţa activă sau la oricare dintre excipienti (lista excipienților se
regaseste în rezumatul caracteristicilor produsului).
V. Atenționări și precauții speciale pentru utilizare
Potențială toxicitate embrio-fetală
În studiile efectuate la animale a fost observată apariţia toxicităţii embrio-fetale. Pacienţii cu
potenţial reproductiv trebuie informaţi cu privire la riscuri şi trebuie să utilizeze metode
contraceptive cu grad înalt de eficacitate pe durata tratamentului şi timp de încă minimum 1
lună după administrarea ultimei doze, în cazul pacienţilor de sex feminin, şi 4 luni după
administrarea ultimei doze, în cazul pacienţilor de sex masculin. Înainte de iniţierea terapiei
cu risdiplam trebuie exclusă prezenţa sarcinii la pacientele cu potenţial fertil.
Efecte potenţiale asupra fertilităţii masculine
Având în vedere observațiile din studiile pe animale, pacienţii de sex masculin nu trebuie să
doneze spermă pe durata tratamentului şi timp de încă 4 luni după administrarea ultimei doze
de risdiplam. Înainte de a se iniţia tratamentul, trebuie purtată o discuţie despre strategiile de
prezervare a fertilităţii cu pacienţii de sex masculin având potențial fertil. Efectele risdiplam
asupra fertilităţii masculine nu au fost investigate la om.
Toxicitate retiniană
Efectele risdiplam asupra structurii retinei, observate în studiile de siguranță nonclinice nu au
fost observate în studiile clinice la pacienții cu AMS. Cu toate acestea, studiile pe termen lung
sunt încă limitate. Prin urmare, relevanța clinică a acestor rezultate nonclinice pe termen lung
nu a fost stabilită.
Utilizarea cu terapie genică pentru AMS
Eficacitatea tratamentului cu risdiplam, atunci când este utilizat la pacienții cărora li s-a
administrat anterior terapie genică SMN1, nu a fost încă stabilit.
VI. Monitorizarea tratamentului/criterii de evaluare a eficacității terapeutice
VI.I. Monitorizarea pacientului
A. Pacienţi cu AMS Tip 1
Monitorizarea evoluției se face la fiecare 6 luni de la începerea administrării, în centrele
acreditate care au inițiat tratamentul cu risdiplam.
Se vor efectua evaluarile motorii cu ajutorul scalelor de evaluare standard:
– numărul de puncte – Scala Hammersmith Infant Neurological Examination (HINE) –
Secţiunea 2
– numărul de puncte – Children’s Hospital of Philadelphia Infant Test for
Neuromuscular Disease (CHOP-INTEND).
Pacientul va fi monitorizat pe baza Fişei Iniţiale şi Fişei de follow-up.
1. Date generale:
– data apariţiei simptomelor,
– data diagnosticului,
– status-ul vaccinărilor conform schemei Ministerului Sănătății,
– date antropometrice (greutate, înălţime, IMC), curbele de creștere (WHO),
– respirație paradoxală DA/NU,
– scolioză: DA/NU,
– retracții musculare: DA (și localizare) /NU.
2. Date despre îngrijirile de suport:
– modul de alimentaţie: oral/sondă nasogastrică/gastrostomie
– kinetoterapie: DA/NU
– fizioterapie respiratorie: DA/NU
– utilizare “cough-assist.”: DA/NU
– ventilaţie asistată: DA/NU, cu caracter non-invaziv/invaziv, diurnă / nocturnă .
3. Teste de laborator:
Se recomandă efectuarea lor la iniţierea tratamentului şi la fiecare 6 luni:
– hemoleucogramă completă,
– teste de coagulare: INR, TTPa, fibrinogen
– teste ale funcţiei hepatice: ALT, AST, bilirubina,
– teste ale funcţiei renale: creatinina, uree, proteinurie,
– VSH, proteina C reactivă.
B. Pacienţi cu AMS tip 2 sau 3
Monitorizarea evoluției se face la fiecare 6 luni, de la începerea administrării, în centrele
acreditate care au inițiat tratamentul cu risdiplam.
Se vor efectua evaluari motorii cu ajutorul scalelor de evaluare standard:
– numărul de puncte aferente Scalei Hammersmith Functional Motor Scale Expanded
for SMA (HFMSE)
– distanța exprimată în metri obținută la testul de mers – 6 Minutes Walking Test
(6MWT).
– numărul de puncte obţinut la testul pentru funcţionalitatea membrului superior- Upper
Limb Module (RULM), versiunea revizuită.
1. Date generale:
– data apariţiei simptomelor.
– data diagnosticului.
– status-ul vaccinărilor conform schemei Ministerului Sănătății.
– date antropometrice (greutate, înălţime, IMC), curbele de creștere (WHO) – pacienții
pediatrici.
– scolioză: DA/NU.
– retracții musculare: DA (și localizare) /NU.
2. Date despre îngrijirile de suport:
– modul de alimentaţie: oral/sondă nasogastrică/gastrostomie
– kinetoterapie: DA/NU
– fizioterapie respiratorie: DA/NU
– utilizare cough-assist: DA/NU
– ventilaţie asistată: DA/NU, cu caracter non-invaziv/invaziv, diurnă / nocturnă.
3. Teste de laborator:
Se recomandă efectuarea lor la iniţierea tratamentului şi la fiecare 6 luni:
– hemoleucogramă completă
– teste de coagulare: INR, TTPa, fibrinogen
– teste ale funcţiei hepatice: ALT, AST, bilirubina
– teste ale funcţiei renale: creatinina, uree, proteinurie
– VSH, proteina C reactivă.
VI.II. Criterii de evaluare a eficacităţii tratamentului
A. Pacienţi care nu au achizitionat pozitia sezand fara sprijin:
a. Evaluarea funcţiei musculare
– în vederea stabilirii eficacității tratamentului : se va face la 12 luni și apoi la 24 luni de
la începerea terapiei.
Pacienții pediatrici (< 18 ani):
– se vor folosi criteriile de evaluare conform standardelor pentru dezvoltarea copilului
ale Organizaţiei
– Mondiale a Sănătăţii (OMS) (ex. susţine capul da/nu, stă în poziție sezând da/nu; se
deplasează da/nu).
– numărul de puncte – Scala Hammersmith Infant Neurological Examination (HINE) –
Secţiunea 2
– numărul de puncte – Children’s Hospital of Philadelphia Infant Test for
Neuromuscular Disease (CHOPINTEND).
Pacienții adulți:
– numărul de puncte aferente Scalei Hammersmith Functional Motor Scale Expanded
for SMA (HFMSE)
– numărul de puncte obţinut la testul pentru funcţionalitatea membrului superior- Upper
Limb Module (RULM), versiunea revizuită.
b. Evaluarea funcţiei respiratorii
– numărul de ore/zi în care este necesar suportul ventilator
c. Alte criterii:
– numărul episoadelor de infecţii ale căilor respiratorii inferioare faţă de vizita
precedentă.
– necesitatea internărilor pentru infectii respiratorii – NU/DA (de câte ori).
– necesitatea internărilor pentru alte motive – NU/DA (de câte ori).
B. Pacienţi care au achizitionat pozitia sezand fara sprijin sau pacienții ambulanți
a. Evaluarea funcţiei musculare:
– în vederea stabilirii eficacității tratamentului : se va face la 24 luni de la începerea
terapiei.
– mers DA/NU, independent/dispozitive mecanice.
– numărul de ore petrecute în scaunul rulant.
– numărul de puncte aferente Scalei Hammersmith Functional Motor Scale Expanded
for SMA (HFMSE)
– distanța exprimată în metri obținută la testul de mers – 6 Minutes Walking Test
(6MWT).
– numărul de puncte obţinut la testul pentru funcţionalitatea membrului superior- Upper
Limb Module (RULM), versiunea revizuită.
b. Evaluarea funcţiei respiratorii:
– numărul de ore/zi în care este necesar suportul ventilator.
– spirometria (≥ 5 ani)/ PCF: FVC şi FEV1.
c. Alte criterii:
– numărul episoadelor de infecţii ale căilor respiratorii inferioare faţă de vizita
precedentă.
– necesitatea internărilor pentru infectii respiratorii – NU/DA (de câte ori).
– necesitatea internărilor pentru alte motive – NU/DA (de câte ori
VII. Criterii pentru întreruperea tratamentului
VII.A. Generale:
Pacientul prezintă efecte adverse severe asociate cu administrarea risdiplam.
Lipsa complianței la tratament prin nerespectarea regimului de administrare, intarzierea cu
mai mult de 30 zile la programarile de evaluare din centrele acreditate de management al
patologiei AMS, cu excepția unor situații care pot fi documentate.
Pacientul sau reprezentantul său legal (în cazul minorilor) nu mai dorește administrarea
tratamentului și își retrage consimțământul.
VII.B. Specifice
Pacienţi cu AMS Tip 1
Se va lua în considerare întreruperea tratamentului dacă la evaluarea clinică obiectivă
efectuată dupa 24 luni de tratament se constată că apare o scădere semnificativă a funcţiei
motorii (măsurată cu Scala HINE secţiunea 2) sau respiratorie (măsurată prin schimbări în
suportul ventilator).
• Se consideră semnificativă o scădere a funcţiei motorii sau pierderea unui punct la
fiecare dintre criteriile motorii din Scala HINE – secţiunea 2 (controlul capului,
răsucire, şedere, mers târât, susţinere în picioare, mers), cu excepţia categoriei mişcare
de pedalare, la care se consideră semnificativă pierderea a două puncte.
• Se consideră semnificativă o scădere a funcţiei respiratorii dacă este necesară
instituirea ventilaţiei asistate (invazivă sau noninvazivă) permanente (>16 h/zi, > 21 de
zile consecutive, ventilaţie continua sau traheostomie, în absenţa unui episod acut
reversibil).
Pacienţi cu AMS Tip 2 sau Tip 3
Se va lua în considerare întreruperea tratamentului dacă la evaluarea clinică obiectivă
efectuată dupa 24 luni de tratament:
1) Nu se produce o îmbunătăţire de >3 puncte pe scala Hammersmith Functional Motor
Scale Expanded for SMA (HFMSE).
• La pacienţii care au capacitatea de a merge se va lua în considerare suplimentar
dacă nu apare o creştere a distanţei parcurse la testul mersului în 6 minute (6 MWT)
de >30 metri.
• La pacienţii care nu au capacitatea de a merge, se va lua în considerare suplimentar,
dacă nu apare o creştere cu >2 puncte pe scala adresată membrelor superioare
(RULM).
Testările cu cele două scale adiţionale se vor face concomitent cu HFMSE.
2) În cazul deteriorării importante a funcţiei respiratorii, dacă este necesară instituirea
ventilaţiei asistate (invazivă sau noninvazivă) permanente (> 16 h/zi ventilaţie, > 21 de
zile consecutive continuă în absenţa unui episod acut reversibil sau traheostomia), fără
existenţa unei cauze acute.
Notă: Evaluarea pe baza scalelor menţionate se va face de către medici/kinetoterapeuți cu
experienţă în utilizarea lor.
VIII. Prescriptori
Tratamentul va fi inițiat de către medicii din specialitatea neurologie pediatrică şi neurologie
care profesează în cadrul centrelor acreditate în derularea programului național pentru tratarea
bolilor rare – componenta P6.24- amiotrofia spinala.
Inițierea tratamentului – în cazul pacienților minori – se va realiza în Centrele acreditate
pentru acest program, pentru ca pacienții / părinții (în cazul sugarilor și al copiilor) să poată fi
instruiți și supravegheați / susținuți în cursul primelor administrări de risdiplam.
1. Dosarul pacientului este realizat și păstrat de fiecare medic curant în cadrul instituției,
recomandarea pentru iniţierea tratamentului cu risdiplam se face după evaluarea
pacientului, confirmarea diagnosticului și evaluarea eligibilitatii.
2. Eliberarea medicamentului se face prin intermediul farmaciilor cu regim de circuit închis,
la inițierea tratamentului și a celor cu circuit deschis, pentru continuarea tratamentului, pe
bază de prescripţie medicală electronică eliberată lunar de către medicii din specialitatile
neurologie pediatrica, pediatrie sau neurologie (pentru pacienţii cu vârsta mai mare de 18
ani).
3. Medicul curant are obligaţia să discute cu pacientul sau cu părintele sau tutorele legal al
pacientului pediatric evoluția bolii, prognosticul şi riscurile de complicaţii şi necesitatea
administrării corecte a tratamentului. Medicul curant care întocmeşte dosarul poartă
întreaga răspundere pentru corectitudinea informaţiilor medicale incluse şi documentele
sursă ale pacientului, punându-le la dispoziţia Comisiilor de control ale Caselor de
Asigurări de Sănătate. Medicul curant va asigura permanent caracterul confidenţial al
informaţiei despre pacient.
4. Medicul curant va solicita pacientului sau părintelui sau tutorelui legal să semneze o
declaraţie de consimţământ privind tratamentul aplicat şi prelucrarea datelor sale medicale
în scopuri ştiinţifice şi medicale. Declaraţia de consimţământ privind tratamentul aplicat va
fi reînnoită doar dacă se modifică schema terapeutică sau medicul curant. În restul
situaţiilor declaraţia de consimţământ se întocmeşte o singură dată.
Centre acreditate în derularea programului național de boli rare- componenta P6.24
amiotrofia spinală:
Centre pentru pacienții AMS pediatrici:
– Spitalul Clinic de Psihiatrie “Prof.Dr Alexandru Obregia” Bucuresti-Sectia Clinică de
Neurologie Pediatrica
– Spitalul Clinic pentru Copii “ Dr Victor Gomoiu” București- Secţia Clinică de
Neurologie Pediatrică;
– Centrul Național Clinic de Recuperare Neuropsihomotorie Dr Nicolae Robanescu
Bucuresti
– Spitalul Clinic de Urgență pentru Copii Cluj-Napoca- Secția Clinică de Neurologie
Pediatrica
– Spitalul Clinic de Urgență pentru Copii “Louis Turcanu” Timișoara- Secția Clinică de
Neurologie Pediatrica
– Spitalul Clinic de Pediatrie Sibiu- Compartiment Neurologie Pediatrica
– Spitalul Clinic Judetean de Urgenta Constanta- Compartiment Neurologie Pediatrica
Centre pentru pacienții AMS adulți:
– Institutul Clinic Fundeni- Sectia Clinica de Neurologie II
– Spitalul Clinic de Urgență Prof. Dr Agrippa Ionescu Balotesti- Secția Clinică
Neurologie
– Spitalul Clinic Municipal Cluj-Napoca- Secția Clinică Neurologie
– Spitalul Clinic Judetean de Urgenta Targu Mures- Secția Clinică de Neurologie I
– Spitalul Clinic Județean de Urgență “Pius Brînzeu” Timișoara- Secția Clinică
Neurologie II
– Spitalul Clinic CF Timișoara- Secția Clinică Neurologie
– Spitalul Clinic Judetean de Urgenta Constanta- Secția Clinică Neurologie.”