Protocol terapeutic
conform ordin MS/CNAS NR 564/499/2021
L04AX06 – DCI POMALIDOMIDUM
L04AX06 – DCI POMALIDOMIDUM
Citeste mai mult: https://www.formaremedicala.ro/l04ax06-dci-pomalidomidum/
I. DEFINIŢIA AFECŢIUNII
• MIELOMUL MULTIPLU (MM)
II. CRITERII DE INCLUDERE
• În asociere cu bortezomib și dexametazonă, pentru tratamentul pacienților adulți cu mielom
multiplu cărora li s-a administrat cel puțin o schemă de tratament anterioară, inclusiv
lenalidomidă.
• În asociere cu dexametazona, pentru tratamentul pacienților adulți cu mielom multiplu recidivat
și refractar, cărora li s-au administrat cel puțin două scheme de tratament anterioare, incluzând
lenalidomidă și bortezomib, și care au prezentat progresia bolii la ultimul tratament.
III. CRITERII DE EXCLUDERE
• hipersensibilitate la substanţa activă sau la oricare dintre excipienţi
• sarcina
• femei aflate în perioada fertilă, dacă nu sunt îndeplinite toate condițiile Programului de
prevenire a sarcinii
• pacienți de sex masculin care nu pot urma sau respecta măsurile contraceptive necesare
IV. TRATAMENT
Tratamentul trebuie inițiat și monitorizat sub supravegherea unor medici cu experiență în tratamentul
mielomului multiplu; schema de tratament va fi menținută sau modificată, în funcție de datele clinice și de
laborator.
Mod de administrare:
– se administrează oral, la aceeași oră în fiecare zi.
– capsulele nu trebuie deschise, sfărâmate sau mestecate ; capsulele trebuie înghițite întregi, de
preferință cu apă, cu sau fără alimente
– dacă pacientul uită să administreze o doză de pomalidomidă într-o zi, atunci acesta trebuie să utilizeze
doza prescrisă în mod normal în ziua următoare; doza nu trebuie ajustată pentru a compensa doza
omisă în zilele anterioare
– se recomandă apăsarea pe un singur capăt al capsulei pentru scoaterea acesteia din blister, reducând
astfel riscul deformării sau ruperii capsulei.
Doza recomandată:
• Pomalidomidă în asociere cu bortezomib și dexametazonă
Pomalidomida: doza inițială recomandată este de 4 mg o dată pe zi, administrată pe cale orală, în zilele 1
până la 14 ale fiecărui ciclu repetat de 21 zile.
Bortezomib: doza inițială recomandată de este de 1,3 mg/m2, administrată o dată pe zi pe cale
intravenoasă sau subcutanată, ȋn zilele prezentate ȋn Tabelul 1. Doza recomandată de dexametazonă este
de 20 mg o dată pe zi, administrată pe cale orală, ȋn zilele prezentate ȋn Tabelul 1.
Tratamentul cu pomalidomidă în asociere cu bortezomib și dexametazonă trebuie administrat până la
apariția progresiei bolii sau a unei toxicități inacceptabile
Pomalidomida este administrată în asociere cu bortezomib și dexametazonă, așa cum este prezentat în
tabelul 1.
Tabelul 1. Schema terapeutică recomandată pentru Imnovid în asociere cu bortezomib și
dexametazonă
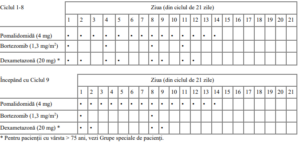
Modificarea sau întreruperea dozei de pomalidomidă
Pentru a începe un nou ciclu de tratament cu pomalidomidă, numărul de neutrofile trebuie să fie ≥ 1 x
109/l și numărul de trombocite trebuie să fie ≥ 50 x 109/l.
Instrucțiunile privind întreruperea sau scăderea dozei de pomalidomidă în cazul reacțiilor adverse
asociate sunt prezentate în Tabelul 2, iar nivelurile de doză sunt definite în Tabelul 3 de mai jos:
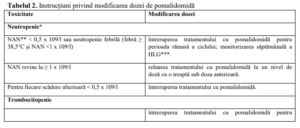
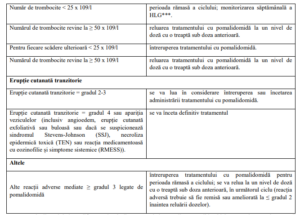
∞ Instrucțiunile privind modificarea dozei din acest tabel se aplică pomalidomidei în asociere cu bortezomib și
dexametazonă și pomalidomidei în asociere cu dexametazonă.
*În caz de neutropenie, medicul trebuie să ia în considerare utilizarea factorilor de creștere. **NAN – Număr absolut de
neutrofile, ***HLG – Hemograma completă.
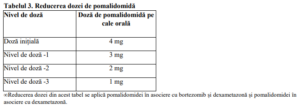
Dacă reacțiile adverse apar după scăderi ale dozelor de până la 1 mg, administrarea medicamentului
trebuie oprită.
In cazul in care nu este disponibila in Romania decat forma farmaceutica Pomalidomida 4 mg, in cazul in
care apar reactii adverse care nu pot fi gestionate de catre medical specialist se recomanda intreruperea
temporara a tratamentului.
Modificarea sau întreruperea dozei de dexametazonă
Instrucțiunile privind întreruperea sau scăderea dozei pentru dexametazonă cu doză scăzută ȋn cazul
reacțiilor adverse asociate, sunt prezentate în Tabelele 4 și 5 de mai jos.
Tabelul 4. Instrucțiuni privind modificarea dozei de dexametazonă
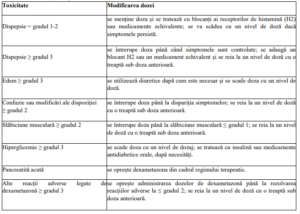
Dacă rezolvarea reacțiilor toxice se prelungește peste 14 zile, atunci se reia doza de dexametazonă la un
nivel de doză cu o treaptă sub doza anterioară.
Tabelul 5. Scăderea dozei de dexametazonă


Dexametazona trebuie oprită dacă pacientul nu poate tolera doza de 8 mg în cazul celor cu vârsta ≤ 75 ani,
sau doza de 4 mg în cazul celor cu vârsta > 75 ani.
În cazul încetării definitive a oricărui component al schemei de tratament, continuarea terapiei cu
medicamente rămase este la latitudinea medicului.
• Pomalidomidă în asociere cu dexametazona
Pomalidomida: doza inițială recomandată este de 4 mg o dată pe zi, administrată pe cale orală în zilele 1
până la 21 ale ciclurilor repetate de 28 de zile.
Dexametazona: doza recomandată este de 40 mg o dată pe zi, administrată pe cale orală, în zilele 1, 8, 15
și 22 ale fiecărui ciclu de tratament de 28 zile.
Tratamentul cu pomalidomidă în asociere cu dexametazonă trebuie administrat până la apariția progresiei
bolii sau a unei toxicități inacceptabile.
Modificarea sau întreruperea dozei de pomalidomidă
Instrucțiunile privind întreruperea sau scăderea dozei de pomalidomidă în cazul reacțiilor adverse mediate
sunt prezentate în Tabelele 2 și 3.
Modificarea sau întreruperea dozei de dexametazonă
Instrucțiunile privind modificarea dozei de dexametazonă în cazul reacțiilor adverse asociate sunt
prezentate în Tabelul 4. Instrucțiunile privind scăderea dozei de dexametazonă în cazul reacțiilor adverse
asociate sunt prezentate în Tabelul 6 de mai jos. Cu toate acestea, deciziile privind întreruperea/reluarea
dozei sunt la latitudinea medicului, conform versiunii actuale a Rezumatului caracteristicilor produsului
(RCP).
Tabelul 6. Scăderea dozei de dexametazonă
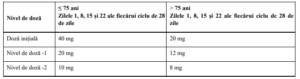
Dexametazona trebuie oprită dacă pacientul nu poate tolera doza de 10 mg în cazul celor cu vârsta ≤ 75
ani, sau doza de 8 mg în cazul celor cu vârsta > 75 ani.
V. MONITORIZAREA TRATAMENULUI. ATENŢIONĂRI şi PRECAUŢII
A. Teratogenicitate
a. Pentru pacienții de sex feminin:
– Pomalidomida, asemănătoare din punct de vedere structural cu talidomida, nu trebuie utilizată în
timpul sarcinii deoarece se prevede un efect teratogen.
– Condițiile Programului de prevenire a sarcinii trebuie îndeplinite în cazul tuturor pacientelor, cu
excepția cazurilor în care există dovezi sigure privind faptul că pacientele respective nu se mai află
în perioada fertilă.
– Criterii pentru femeile care nu se mai află în perioada fertilă (trebuie îndeplinit cel puțin unul
dintre criterii):
• vârsta > 50 ani și amenoree instalată în mod natural de > 1 an (amenoreea instalată în urma
tratamentului citostatic sau în timpul alăptării nu exclude posibilitatea ca pacienta să fie în
perioada fertilă)
• insuficiență ovariană prematură confirmată de către un medic specialist ginecolog
• salpingo-ovarectomie bilaterală sau histerectomie în antecedente
• genotip XY, sindrom Turner, agenezie uterină
– Pomalidomida este contraindicată femeilor aflate în perioada fertilă, cu excepția cazurilor în care
sunt îndeplinite toate condițiile următoare:
• pacienta înțelege riscul teratogen prevăzut pentru făt
• pacienta înțelege necesitatea utilizării unor măsuri contraceptive eficace, în mod continuu,
începând cu cel puţin 4 săptămâni înaintea inițierii tratamentului, pe toată durata
tratamentului și timp de cel puţin 4 săptămâni după întreruperea definitivă a tratamentului
• pacienta aflată în perioada fertilă trebuie să urmeze toate recomandările privind măsurile
contraceptive eficace, chiar dacă prezintă amenoree
• pacienta trebuie să fie capabilă să aplice măsurile contraceptive eficace
• pacienta este informată și înțelege posibilele consecințele ale unei sarcini, precum și
necesitatea de a consulta imediat un medic, în cazul în care există riscul de a fi gravidă
• pacienta înțelege necesitatea de a începe tratamentul imediat după ce i se eliberează
pomalidomidă, în urma obținerii unui rezultat negativ la testul de sarcină
• pacienta înțelege necesitatea de a efectua teste de sarcină și acceptă efectuarea acestora la
intervale de cel puţin 4 săptămâni, cu excepția cazurilor de sterilizare tubară confirmată
• pacienta confirmă că înțelege riscurile și precauțiile necesare asociate cu utilizarea
pomalidomidei.
– Pentru femeile aflate în perioada fertilă, medicul care prescrie medicamentul trebuie să se asigure
că:
• pacienta îndeplinește condițiile specificate în Programul de prevenire a sarcinii,
incluzând confirmarea faptului că pacienta are o capacitate adecvată de înțelegere
• pacienta a luat cunoștință de condițiile menționate mai sus.
b. Pentru pacienții de sex masculin
– datele farmacocinetice au demonstrat că pomalidomida este prezentă în sperma umană în
timpul tratamentului.
– toți pacienții de sex masculin cărora li se administrează pomalidomidă trebuie să îndeplinească
următoarele condiții:
• pacientul înțelege riscul teratogen prevăzut, în cazul în care are raporturi sexuale cu o
femeie gravidă sau aflată în perioada fertilă.
• pacientul înțelege necesitatea utilizării prezervativelor dacă are raporturi sexuale cu o
femeie gravidă sau aflată în perioada fertilă, care nu utilizează metode contraceptive
eficace pe toată durata tratamentului, pe parcursul întreruperii administrării și timp de 7
zile după întreruperea administrării dozei și/sau oprirea tratamentului; sunt incluși și
pacienții de sex masculin vasectomizați, care trebuie să utilizeze prezervativul dacă au
raporturi sexuale cu o femeie gravidă sau aflată în perioada fertilă, întrucât lichidul
seminal poate conține pomalidomidă chiar și în absența spermatozoizilor.
• pacientul înțelege că, dacă partenera sa rămâne gravidă în timp ce lui i se administrează
pomalidomidă sau în decurs de 7 zile după ce acesta a încetat administrarea
pomalidomidei, trebuie să își informeze imediat medicul curant, iar partenerei sale i se
recomandă să se adreseze unui medic specialist sau cu experiență în teratologie, pentru
evaluare și recomandări.
c. Contracepție
– Femeile aflate în perioada fertilă trebuie să utilizeze cel puţin o metodă contraceptivă eficace timp
de cel puţin 4 săptămâni înainte de tratament, pe durata tratamentului și timp de cel puţin 4
săptămâni după întreruperea definitivă a tratamentului cu pomalidomidă, inclusiv pe durata
întreruperii temporare a tratamentului, cu excepția cazului în care pacienta se angajează să mențină
o abstinență totală și continuă, confirmată lunar.
– Dacă nu utilizează o metodă contraceptivă eficace, pacienta trebuie să se adreseze personalului
medical calificat, pentru recomandări privind inițierea contracepției.
– Metode contraceptive adecvate:
• implantul
• dispozitivul intrauterin cu eliberare de levonorgestrel
• acetatul de medroxiprogesteron, preparat retard
• sterilizarea tubară
• rapoarte sexuale numai cu un partener vasectomizat; vasectomia trebuie confirmată prin
două analize ale spermei cu rezultate negative
• anticoncepționale care inhibă ovulația care conțin numai progesteron (desogestrel)
– Atenţionări:
• pacientele cu mielom multiplu cărora li se administrează pomalidomidă și dexametazonă,
prezintă un risc crescut de tromboembolie venoasă, ca urmare nu se recomandă
administrarea de contraceptive orale combinate; dacă o pacientă utilizează în mod obișnuit
un contraceptiv oral combinat, acesta trebuie înlocuit cu una dintre metodele contraceptive
eficace enumerate mai sus; riscul tromboemboliei venoase se menține timp de 4-6
săptămâni după întreruperea administrării unui contraceptiv oral combinat.
• eficacitatea contraceptivelor steroidiene poate fi scăzută în timpul tratamentului
concomitent cu dexametazonă.
• implanturile și dispozitivele intrauterine cu eliberare de levonorgestrel prezintă un risc
crescut de infecție în momentul inserției și de apariție a hemoragiilor vaginale neregulate;
trebuie evaluată necesitatea instituirii unui tratament profilactic cu antibiotice, în special la
pacientele cu neutropenie.
• introducerea dispozitivelor intrauterine cu eliberare de cupru nu este în general
recomandată, din cauza riscului potențial de infecție în momentul inserției și de apariție a
unor pierderi de sânge semnificative la menstruație, care pot determina complicații la
pacientele cu neutropenie severă sau trombocitopenie severă.
d. Teste de sarcină
– femeile aflate în perioada fertilă trebuie să efectueze, sub supraveghere medicală, teste de sarcină
având o sensibilitate de cel puțin 25 mUI/ml
– în mod ideal, testul de sarcină, emiterea prescripției medicale și eliberarea medicamentului trebuie
efectuate în aceeași zi
– la femeile aflate în perioada fertilă, pomalidomida trebuie eliberată într-un interval de 7 zile de la
data emiterii prescripției medicale.
• Înaintea inițierii tratamentului
– testul de sarcină trebuie efectuat, sub supraveghere medicală, în timpul consultației
medicale în care se prescrie pomalidomidă sau într-un interval de 3 zile înaintea
consultației, în condițiile în care pacienta a utilizat o metodă contraceptivă eficace timp
de cel puțin 4 săptămâni.
– testul trebuie să confirme faptul că pacienta nu este gravidă în momentul inițierii
tratamentului cu pomalidomidă.
• Monitorizarea pacientelor și oprirea tratamentului
– testul de sarcină trebuie repetat, sub supraveghere medicală, cel puţin la fiecare 4
săptămâni, inclusiv după cel puţin 4 săptămâni de la încheierea tratamentului, cu
excepția cazurilor de sterilizare tubară confirmată.
– testele de sarcină trebuie efectuate în ziua consultației medicale în care se prescrie
medicamentul sau în interval de 3 zile înaintea acestei consultații.
e. Precauții suplimentare
– pacienții trebuie instruiți să nu dea niciodată acest medicament altei persoane, iar la sfârșitul
tratamentului să restituie farmacistului toate capsulele neutilizate.
– pacienții nu trebuie să doneze sânge sau spermă în timpul tratamentului (inclusiv în cursul
întreruperilor administrării dozei) și timp de 7 zile după întreruperea tratamentului cu
pomalidomidă.
– prescripția la femeile aflate la vârsta fertilă poate fi efectuată pe o durată maximă de 4 săptămâni
iar prescripția pentru toți ceilalți pacienți poate fi efectuată pe o durată maximă de 12 săptămâni.
B. Alăptarea.
– din cauza reacțiilor adverse posibile ale pomalidomidei la copiii alăptați, trebuie luată decizia fie
de a întrerupe alăptarea, fie de a întrerupe administrarea medicamentului, având în vedere
beneficiul alăptării pentru copil și beneficiul terapiei pentru femeie.
C. Evenimente hematologice (neutropenie / anemie / trombocitopenie):
– hemograma completă trebuie efectuată la momentul inițial, săptămânal în primele 8 săptămâni și
apoi lunar.
– poate fi necesară modificarea dozei
– poate fi necesară administrarea substituției cu produse de sânge și/sau factori de creștere.
D. Evenimente tromboembolice (predominant tromboză venoasă profundă și embolie pulmonară) și
evenimente trombotice arteriale (infarct miocardic și accident vascular cerebral):
– evaluarea atentă a factorilor de risc preexistenți ai pacientului
– pacienții cu factori de risc cunoscuți pentru tromboembolie – incluzând tromboză precedentă –
trebuie monitorizați strict
– scăderea la minim a tuturor factorilor de risc care pot fi modificați (ex: fumat, hipertensiune
arterială și hiperlipidemie)
– se recomandă tratamentul anticoagulant (cu excepția cazului în care acesta este contraindicat):
acidul acetilsalicilic, warfarina, heparina sau clopidogrel, în special la pacienții cu factori de risc
trombotic suplimentari.
– medicamentele eritropietice, ca și medicamentele care pot crește riscul de evenimente
tromboembolice, trebuie utilizate cu precauție.
E. Tumori primare suplimentare (ex: cancerul cutanat nemelanomatos)
– evaluarea atentă a pacienților înaintea și în timpul tratamentului, utilizând măsurile standard de
screening al neoplaziilor în vederea identificării tumorilor maligne primare și începerea
tratamentului conform indicațiilor.
F. Reacții alergice şi reacţii cutanate severe
– la utilizarea pomalidomidei au fost raportate angioedem și reacții cutanate severe, inclusiv
Sindrom Stevens Johnson (SSJ), necroliză epidermică toxică (TEN) sau reacție la medicament cu
eozinofilie și simptome sistemice (RMESS)
– administrarea pomalidomidei trebuie întreruptă în caz de erupție cutanată exfoliativă sau buloasă
sau dacă se suspectează SSJ, TEN sau RMESS și nu trebuie reluată după întreruperea administrării
din cauza acestor reacții.
– în caz de angioedem, administrarea de pomalidomidă trebuie încetată definitiv.
– pacienţilor cu antecedente de erupții cutanate tranzitorii asociate cu administrarea de
lenalidomidă sau talidomidă nu trebuie să li se administreze pomalidomidă
G. Reactivarea hepatitei B
– trebuie stabilit statutul viral al hepatitei B înainte de inițierea tratamentului cu pomalidomidă.
– pentru pacienții cu rezultat pozitiv la testul pentru infecția cu VHB, se recomandă adresarea
– către un medic specialist în tratamentul hepatitei B.
– trebuie procedat cu prudență la utilizarea pomalidomidei în asociere cu dexametazonă la pacienții
cu antecedente de infecție cu VHB, inclusiv pacienții care au status pozitiv pentru anticorpi antiHBc, dar negativ pentru AgHBs; acești pacienți trebuie monitorizați cu atenție pentru depistarea
semnelor și simptomelor de infecție activă cu VHB pe parcursul tratamentului.
H. Insuficienţa renală
– la pacienţii aflaţi in regim de hemodializă, în zilele în care se efectuează ședințe de hemodializă,
doza de pomalidomidă trebuie administrată după efectuarea hemodializei.
I. Disfuncție cardiacă
– s-au raportat evenimente cardiace, inclusiv insuficiență cardiacă congestivă, edem pulmonar și
fibrilație atrială, în principal la pacienți cu boală cardiacă preexistentă sau factori de risc cardiac.
– precauție adecvată; monitorizare periodică pentru depistarea semnelor sau simptomelor de
evenimente cardiace.
J. Boală pulmonară interstițială (BPI)
– evaluare precaută a pacienților cu debut acut sau cu o agravare inexplicabilă a simptomelor
pulmonare, în vederea excluderii BPI.
– tratamenul cu pomalidomidă trebuie întrerupt pe durata investigării acestor simptome și, în cazul
confirmării BPI, trebuie inițiat tratamentul adecvat.
– administrarea pomalidomidei trebuie reluată numai după o evaluare completă a beneficiilor și
riscurilor.
K. Neuropatie periferică
– la pacienții cu neuropatie periferică manifestă ≥ gradul 2 se impune precauție când se ia în
considerare tratamentul cu pomalidomidă
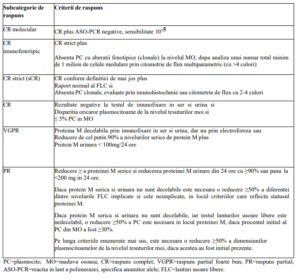
VI. CRITERII DE EVALUARE A EFICACITĂȚII TERAPEUTICE
Se utilizează criteriile elaborate de către Grupul Internațional de Lucru pentru Mielom (IMWG).
VII. PRESCRIPTORI:
Iniţierea și continuarea tratamentului se face de către medicii din specialitatea hematologie.”
Cele mai noi stiri medicale:










