Protocol terapeutic
conform ordin MS/CNAS NR 564/499/2021
L01XX71 – DCI TISAGENLECLEUCEL
L01XX71 – DCI TISAGENLECLEUCEL
Citeste mai mult: https://www.formaremedicala.ro/l01xx71-dci-tisagenlecleucel/
1. Leucemie acută limfoblastică (LAL) cu celule B
I. DEFINIŢIA AFECŢIUNII:
• Leucemie acută limfoblastică (LAL) cu celule B, refractara, în recădere post-transplant, în a
doua recădere sau recăderi ulterioare.
II. CRITERII DE INCLUDERE:
• Pacienții copii și adolescenți și pacienții adulți tineri, cu vârsta cuprinsă până la 25 ani
inclusiv, cu leucemie acută limfoblastică (LAL) cu celule B, refractara, în recădere
post-transplant, în a doua recădere sau recăderi ulterioare;
Nota. La pacientii cu varsta sub 3 ani includerea in tratament se va realiza numai dupa dupa o
atenta analiza beneficiu-risc
III. CONTRAINDICATII:
• Hipersensibilitate la substanța activă sau la oricare dintre excipienți;
• Trebuie avute în vedere contraindicațiile privind chimioterapia de limfodepleție.
IV. TRATAMENT
• Tisagenlecleucel trebuie administrat într-un centru calificat de tratament;
• Terapia trebuie inițiată sub îndrumarea și supervizarea unui cadru medical experimentat în
tratarea neoplaziilor hematologice și instruit pentru administrarea medicamentului și
monitorizarea pacienților tratați cu tisagenlecleucel;
• Înainte de administrarea perfuziei, trebuie să fie disponibil tocilizumab și echipament de
urgență pentru fiecare pacient pentru eventualitatea apariției sindromului de eliberare de
citokine. Centrul de tratament trebuie să aibă acces la doze suplimentare de tocilizumab în
maximum 8 ore;
• Tisagenlecleucel este destinat exclusiv utilizării autologe;
• De regulă, fabricarea și eliberarea tisagenlecleucel durează 3-4 săptămâni.
• Tisagenlecleucel se administreaza o singura data.
• Tratamentul va fi initiat dupa obtinerea consimtamantului informat al
pacientului/apartinatorilor acestuia.
Doze
Doze la pacienții copii și adolescenți și la pacienții adulți tineri, cu LAL cu celulă de tip B
– Pentru pacienții cu o greutate corporală de 50 kg și sub: 0,2 până la 5,0 x 106 celule T CAR
viabile/kg corp;
– Pentru pacienții cu o greutate corporală de peste 50 kg: 0,1 până la 2,5 x 108 celule T CAR
viabile (fără a fi în funcție de greutatea corporală).
Condiții premergătoare tratamentului (chimioterapie de limfodepleție)
Se recomandă administrarea chimioterapiei de limfodepleție înainte de administrarea perfuziei cu
tisagenlecleucel dacă, în intervalul de o săptămână de dinaintea administrării perfuziei, numărul
de leucocite nu este ≤1000 celule/μl.
Se recomandă perfuzarea tisagenlecleucel la 2 până la 14 zile de la finalizarea chimioterapiei de
limfodepleție. Disponibilitatea tisagenlecleucel trebuie confirmată înainte de începerea regimului
de limfodepleție. Dacă există o întârziere de peste 4 săptămâni între finalizarea chimioterapiei de
limfodepleție și perfuzare și dacă numărul de leucocite este >1000 celule/μl, atunci pacientului
trebuie să i se administreze din nou chimioterapie de limfodepleție înainte de a i se administra
tisagenlecleucel.
LAL cu celulă de tip B
Regimul recomandat de chimioterapie de limfodepleție este:
– Fludarabină (30 mg/m2 intravenos, zilnic, timp de 4 zile) și ciclofosfamidă (500 mg/m2
intravenos, zilnic, timp de 2 zile, începând din ziua administrării primei doze de
fludarabină).
În cazul în care pacientul a prezentat anterior cistită hemoragică de gradul 4 la administrarea
ciclofosfamidei sau a demonstrat o stare chimiorefractară în urma unui regim care a conținut
ciclofosfamidă, administrat cu scurt timp înaintea chimioterapiei de limfodepleție, atunci trebuie
utilizată următoarea schemă:
– Citarabină (500 mg/m2 intravenos, zilnic, timp de 2 zile) și etoposid (150 mg/m2 intravenos,
zilnic, timp de 3 zile, începând din ziua administrării primei doze de citarabină).
Chimioterapia de limfodepleție poate fi omisă dacă leucograma pacientului indică ≤1000
celule/µl cu 1 săptămână înainte de perfuzarea tisagenlecleucel.
Tratament premergător
Pentru a reduce la minimum posibilele reacții acute asociate perfuziei, se recomandă ca
pacienților să li se administreze tratament prealabil cu paracetamol și difenhidramină sau un alt
medicament antihistaminic H1 cu aproximativ 30 până la 60 minute înainte de perfuzia
tisagenlecleucel. Nu trebuie utilizați corticosteroizi decât în caz de urgență cu potențial letal.
Monitorizare după perfuzare
– Pacienții trebuie monitorizați zilnic, în primele 10 zile de la perfuzare, pentru a se identifica
semne și simptome ale unui posibil sindrom de eliberare de citokine, evenimente
neurologice și alte toxicități. Trebuie avuta în vedere spitalizarea pacientului în primele
10 zile după perfuzare și la apariția primelor semne/simptome ale sindromului de eliberare
de citokine și/sau ale evenimentelor neurologice;
– După primele 10 zile de la perfuzare, pacientul trebuie monitorizat la latitudinea medicului
– Pacienții trebuie sfătuiți să rămână în proximitatea (la o distanță de maximum 2 ore)
centrului calificat de tratament timp de minimum 4 săptămâni după perfuzare.
Mod de administrare
Tisagenlecleucel este numai pentru administrare intravenoasă.
Măsuri de precauție de avut în vedere înainte de manipularea sau administrarea medicamentului
Acest medicament conține celule sanguine umane modificate genetic. Cadrele medicale care
manipulează tisagenlecleucel trebuie să ia măsuri adecvate de precauție (să poarte mănuși și
ochelari de protecție) pentru a evita posibila transmitere a bolilor infecțioase, asemănător oricărui
material de origine umană.
Pregătirea pentru administrarea perfuziei
Înainte de perfuzarea tisagenlecleucel, trebuie să se confirme faptul că identitatea pacientului
corespunde informațiilor unice, esențiale, ale pacientului de pe punga(ile) de perfuzare.
Decongelarea tisagenlecleucel și administrarea perfuziei trebuie sincronizate. Momentul de
începere a perfuzării trebuie confirmat în avans și ajustat în funcție de decongelare astfel încât
tisagenlecleucel să fie gata de administrare prin perfuzare atunci când pacientul este pregătit.
Odată decongelat și ajuns la temperatura ambientală (20°C-25°C), tisagenlecleucel trebuie
perfuzat în decurs de 30 minute pentru a menține nivelul maxim de viabilitate a medicamentului,
inclusiv orice întrerupere pe durata perfuzării.
Administrare
Tisagenlecleucel trebuie administrat prin perfuzare intravenoasă, printr-o tubulatură fără latex
pentru administrare intravenoasă, fără filtru de depleție leucocitară, la aproximativ 10 până la
20 ml pe minut, prin curgere gravitațională. Trebuie perfuzat conținutul integral al pungii(ilor) de
perfuzare. Pentru pregătirea tubulaturii, trebuie utilizată soluție de clorură de sodiu de 9 mg/ml
(0,9%) pentru injectare înainte de administrarea perfuziei și pentru clătire după administrarea
acesteia. După perfuzarea volumului complet de tisagenlecleucel, punga de perfuzare trebuie
clătită cu 10 până la 30 ml soluție de clorură de sodiu 9 mg/ml (0,9%), prin clătire inversă pentru
a asigura perfuzarea a cât mai multe celule la pacient.
Dacă volumul de tisagenlecleucel care va fi administrat este ≤20 ml, se poate utiliza injectarea
rapidă intravenos ca metodă alternativă de administrare.
V. MONITORIZAREA TRATAMENTULUI SI PRECAUTII:
• Pentru a asigura trasabilitatea, numele produsului, numărul lotului și numele pacientului
tratat trebuie păstrate pentru o perioadă de 30 ani.
• Nu trebuie efectuată perfuzarea decât după rezolvarea oricărora dintre afecțiunile de mai
jos:
– Reacții adverse grave nerezolvate (mai ales reacții pulmonare, cardiace sau
hipotensiune arterială) determinate de chimioterapii anterioare;
– Infecție activă necontrolată;
– Boală activă grefă-contra-gazdă (GVHD);
– Agravare clinică semnificativă a leucemiei după chimioterapia de limfodepleție.
• Trebuie asigurat tratament adecvat profilactic și terapeutic împotriva infecțiilor. Trebuie
asigurată rezolvarea completă a oricăror infecții existente.
• În cazul neutropeniei febrile, infecția trebuie evaluată și tratată în mod corespunzător cu
antibiotice cu spectru larg, lichide și alte măsuri de susținere, după cum este indicat din
punct de vedere medical.
• Pacienții tratați cu tisagenlecleucel nu trebuie să doneze sânge, organe, țesuturi sau celule.
• La 3 luni de la perfuzare se va evalua raspunsul la tratament definit ca remisie completa
(CR) sau, remisie completa cu hemograma incompleta (CRi)
– Remisia completa (CR) este definita ca <5% blasti in maduva osoasa, fara dovezi de
boala extramedulara si recuperare completa a valorilor hematologice din sangele
periferic (trombocite>100000/µl si numar absolut de neutrofile > 1000/µl) fara
transfuzie sanguina
– Remisie completa cu recuperare hematologica incompleta (CRi) este definita ca <5%
blasti in maduva osoasa, fara dovezi de boala extramedulara si fara recuperare
completa a valorilor hematologice din sangele periferic, cu sau fara transfuzie
sanguina ( trombocite<100 000/µl si numar absolut de neutrofile <1000/µl)
• Monitorizarea raspunsului la tratament al pacientilor dupa administrarea tisagenlecleucel
(prin examenul sangelui periferic si al maduvei osoase, examen SNC, examen fizic si si al
lichidului cefalorahidian) se va efectua lunar in primele 6 luni dupa administrare, ulterior
la fiecare 3 luni timp de pana la 2 ani si apoi la fiecare 6 luni timp de pana la 5 ani
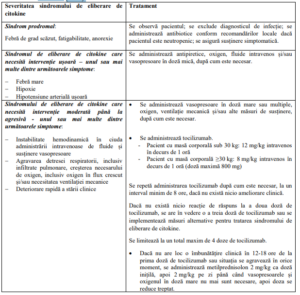
• Sindromul de eliberare de citokine
– Pacienții trebuie monitorizați îndeaproape pentru semne sau simptome ale sindromului
de eliberare de citokine ce pot include: febră crescută, rigiditate, mialgie, artralgie,
greață, vărsături, diaree, diaforeză, erupții cutanate tranzitorii, anorexie, fatigabilitate,
cefalee, hipotensiune arterială, dispnee, tahipnee, hipoxie, insuficiență cardiacă și
aritmie, insuficiență renală și insuficiență hepatică, însoțită de valori crescute ale
aspartat aminotransferazei (AST), valori crescute ale alanin aminotransferazei (ALT)
sau valori crescute ale bilirubinei totale; În unele cazuri, pot apărea coagulare
intravasculară diseminată (DIC), cu niveluri scăzute de fibrinogen, sindromul
scurgerilor la nivelul capilarelor (CLS), sindromul activării macrofagelor (MAS) și
limfohistiocitoză hemofagocitică (HLH) în contextul sindromului de eliberare de
citokine.
– Factorii de risc sunt: încărcătură tumorală accentuată pre-perfuzare, încărcătură
tumorală necontrolată sau accelerată după chimioterapia de limfodepleție, infecție
activă și debut prematur al febrei sau sindromului de eliberare de citokine după
perfuzarea tisagenlecleucel.
– În aproape toate cazurile, apariția sindromului de eliberare de citokine a avut loc între
1 până la 10 zile (debut median în 3 zile) de la perfuzarea tisagenlecleucel. Timpul
median până la rezolvarea sindromului de eliberare de citokine a fost de 8 zile.
Algoritmul de management al sindromului de eliberare de citokine
– Sindromul de eliberare de citokine trebuie tratat exclusiv în funcție de tabloul clinic al
pacientului și conform algoritmului de management al sindromului de eliberare de
citokine furnizat în tabelul de mai jos.
– Terapia pe bază de anti-IL-6, cum este tocilizumab, a fost administrată în cazuri
moderate sau severe de sindrom de eliberare de citokine asociat cu tisagenlecleucel. O
doză de tocilizumab per pacient trebuie să fie la îndemână și disponibilă pentru
administrare înainte de perfuzarea tisagenlecleucel. Centrul de tratament trebuie să
aibă acces la doze suplimentare de tocilizumab în maximum 8 ore.
– În situații de urgență cu potențial letal, se pot administra corticosteroizi.
– Pentru tratarea sindromului de eliberare de citokine asociat cu administrarea
tisagenlecleucel nu se recomandă administrarea antagoniștilor factorului de necroză
tumorală (TNF).
Reacții adverse de natură neurologică
– Pacienții trebuie monitorizați cu privire la evenimente neurologice (encefalopatie, stare de
confuzie sau delir, nivel scăzut de conștiență, convulsii, afazie și tulburare de vorbire). În
cazul evenimentelor neurologice, pacienții trebuie diagnosticați și tratați în funcție de
fiziopatologia existentă și în conformitate cu protocoalele locale.
– Cele mai mult tipuri de evenimente neurologice au apărut în decurs de 8 săptămâni de la
administrarea perfuziei cu tisagenlecleucel și au fost tranzitorii. Timpul median până la
debutul primelor evenimentelor neurologice a fost de 8 zile în LAL cu celulă B. Timpul
median până la rezolvare a fost de 7 zile pentru LAL cu celulă B.
• Pacienții pot prezenta în continuare citopenie timp de câteva săptămâni după chimioterapia de
limfodepleție și perfuzarea tisagenlecleucel și trebuie tratați conform recomandărilor
standard. Nu se recomandă administrarea de factori de creștere mieloizi, mai ales factor de
stimulare a coloniei de celule macrofage (GM-CSF), care pot agrava simptomele sindromului
de eliberare de citokine, în decursul primelor 3 săptămâni după perfuzarea tisagenlecleucel
sau până la rezolvarea sindromului de eliberare de citokine.
• Pacienții tratați cu tisagenlecleucel trebuie monitorizați pe toată durata vieții pentru a se
identifica apariția neoplaziilor secundare.
• Nivelurile imunoglobulinei trebuie monitorizate după tratamentul cu tisagenlecleucel. La
pacienții cu niveluri scăzute de imunoglobulină, trebuie implementate măsuri de precauție,
cum sunt măsuri de precauție împotriva infecțiilor, profilaxie cu antibiotic și înlocuirea
imunoglobulinei în funcție de vârstă și în conformitate cu recomandările standard.
• Pentru a reduce la minimum riscul apariției sindromului lizei tumorale (TLS), pacienții cu
valori crescute ale acidului uric sau cu încărcare tumorală mare trebuie să administreze,
înainte de administrarea perfuziei cu tisagenlecleucel, alopurinol sau un medicament
profilactic alternativ. Semnele și simptomele TLS trebuie monitorizate și evenimentele
trebuie tratate în funcție de recomandările standard.
• Pacienții cu antecedente de tulburare activă a SNC sau insuficiență renală, hepatică,
pulmonară sau cardiacă necesită atenție specială.
• Nu se recomandă ca pacienților să li se administreze tisagenlecleucel în decurs de 4 luni de la
un transplant alogen cu celule stem (SCT) din cauza riscului potențial ca tisagenlecleucel să
agraveze GVHD. Leucafereza pentru fabricarea tisagenlecleucel trebuie efectuată la
minimum 12 săptămâni după SCT alogen.
• Screening-ul pentru HBV, HCV și HIV trebuie efectuat în conformitate cu recomandările
clinice înainte de recoltarea celulelor pentru fabricarea medicamentului. Reactivarea virusului
hepatitei B (HBV) poate avea loc la pacienții tratați cu medicamentele direcționate împotriva
celulelor B și pot determina apariția hepatitei fulminante, insuficienței hepatice și decesului.
• Nu se recomandă tisagenlecleucel dacă pacientul a prezentat recădere cu leucemie CD19-
negativă după tratament anterior anti-CD19.
• Datorită porțiunilor limitate și scurte de informații genetice identice între vectorul lentiviral
utilizat pentru a crea tisagenlecleucel și HIV, unele teste comerciale cu acid nucleic pentru
HIV (NAT) pot determina rezultate fals pozitive.
• Pacienții care nu au fost expuși anterior la dextran și dimetil sulfoxid (DMSO) trebuie
observați cu atenție în primele minute ale perioadei de administrare a perfuziei.
• Tisagenlecleucel nu este recomandat în timpul sarcinii şi la femei aflate la vârsta fertilă care
nu utilizează măsuri contraceptive.
VI. PRESCRIPTORI:
Tratamentului se prescrie si se administreaza de către medicii din specialitatile hematologie și
onco hematologie pediatrica din centrele calificate pentru administrarea tisagenlecleucel dupa
obtinerea avizului Comisiei de terapii celuare a Ministerului Sanatatii.Pentru evaluarea indicatiei
de tisagenlecleucel si aviz se va completa de catre medicul curant Anexa 1 si se va trimite catre
Comisia De Terapii Celulare a MS.
2. Limfom difuz cu celulă mare de tip B (DLBCL)
I. DEFINIŢIA AFECŢIUNII:
• Limfom difuz, cu celulă mare de tip B, recidivant sau refractar (DLBCL)
II. CRITERII DE INCLUDERE:
• Pacienții adulți cu limfom difuz, cu celulă mare de tip B, recidivant sau refractar (DLBCL),
după două sau mai multe linii de terapie sistemică.
III. CONTRAINDICATII:
• Hipersensibilitate la substanța activă sau la oricare dintre excipienți;
• Trebuie avute în vedere contraindicațiile privind chimioterapia de limfodepleție.
IV. TRATAMENT
• Tisagenlecleucel trebuie administrat într-un centru calificat de tratament;
• Terapia trebuie inițiată sub îndrumarea și supervizarea unui cadru medical experimentat în
tratarea neoplaziilor hematologice și instruit pentru administrarea medicamentului și
monitorizarea pacienților tratați cu tisagenlecleucel;
• Înainte de administrarea perfuziei, trebuie să fie disponibil tocilizumab și echipament de
urgență per fiecare pacient pentru eventualitatea apariției sindromului de eliberare de
citokine. Centrul de tratament trebuie să aibă acces la doze suplimentare de tocilizumab în
maximum 8 ore;
• Tisagenlecleucel este destinat exclusiv utilizării autologe;
• De regulă, fabricarea și eliberarea tisagenlecleucel durează 3-4 săptămâni.
• Tisagenlecleucel se administreaza o singura data.
• Tratamentul va fi initiat dupa obtinerea consimtamantului informat al pacientului.
Doze
Doze la pacienții adulți cu DLBCL
– 0,6 până la 6 x 108 celule T CAR viabile (fără a fi în funcție de greutatea corporală).
Condiții premergătoare tratamentului (chimioterapie de limfodepleție)
Se recomandă administrarea chimioterapiei de limfodepleție înainte de administrarea perfuziei cu
tisagenlecleucel dacă, în intervalul de o săptămână de dinaintea administrării perfuziei, numărul
de leucocite nu este ≤1000 celule/μl.
Se recomandă perfuzarea tisagenlecleucel la 2 până la 14 zile de la finalizarea chimioterapiei de
limfodepleție. Disponibilitatea tisagenlecleucel trebuie confirmată înainte de începerea regimului
de limfodepleție. Dacă există o întârziere de peste 4 săptămâni între finalizarea chimioterapiei de
limfodepleție și perfuzare și dacă numărul de leucocite este >1000 celule/μl, atunci pacientului
trebuie să i se administreze din nou chimioterapie de limfodepleție înainte de a i se administra
tisagenlecleucel.
DLBCL
Regimul recomandat de chimioterapie de limfodepleție este:
– Fludarabină (25 mg/m2 intravenos, zilnic, timp de 3 zile) și ciclofosfamidă (250 mg/m2
intravenos, zilnic, timp de 3 zile, începând din ziua administrării primei doze de
fludarabină).
În cazul în care pacientul a prezentat anterior cistită hemoragică de gradul 4 la administrarea
ciclofosfamidei sau a demonstrat o stare chimiorefractară în urma unui regim care a conținut
ciclofosfamidă, administrat cu scurt timp înaintea chimioterapiei de limfodepleție, atunci trebuie
utilizată următoarea schemă:
– Bendamustină (90 mg/m2 intravenos, zilnic, timp de 2 zile).
Chimioterapia de limfodepleție poate fi omisă dacă leucograma pacientului indică ≤1000
celule/µl cu 1 săptămână înainte de perfuzarea tisagenlecleucel.
Tratament premergător
Pentru a reduce la minimum posibilele reacții acute asociate perfuziei, se recomandă ca
pacienților să li se administreze tratament prealabil cu paracetamol și difenhidramină sau un alt
medicament antihistaminic H1 cu aproximativ 30 până la 60 minute înainte de perfuzia
tisagenlecleucel. Nu trebuie utilizați corticosteroizi decât în caz de urgență cu potențial letal.
Monitorizare după perfuzare
– Pacienții trebuie monitorizați zilnic, în primele 10 zile de la perfuzare, pentru a se identifica
semne și simptome ale unui posibil sindrom de eliberare de citokine, evenimente
neurologice și alte toxicități. Trebuie avuta în vedere spitalizarea pacientului în primele
10 zile după perfuzare și la apariția primelor semne/simptome ale sindromului de eliberare
de citokine și/sau ale evenimentelor neurologice.
– După primele 10 zile de la perfuzare, pacientul trebuie monitorizat la latitudinea medicului
– Pacienții trebuie sfătuiți să rămână în proximitatea (la o distanță de maximum 2 ore)
centrului calificat de tratament timp de minimum 4 săptămâni după perfuzare.
Mod de administrare
Tisagenlecleucel este numai pentru administrare intravenoasă.
Măsuri de precauție de avut în vedere înainte de manipularea sau administrarea medicamentului
Acest medicament conține celule sanguine umane modificate genetic. Cadrele medicale care
manipulează tisagenlecleucel trebuie să ia măsuri adecvate de precauție (să poarte mănuși și
ochelari de protecție) pentru a evita posibila transmitere a bolilor infecțioase, asemănător oricărui
material de origine umană.
Pregătirea pentru administrarea perfuziei
Înainte de perfuzarea tisagenlecleucel, trebuie să se confirme faptul că identitatea pacientului
corespunde informațiilor unice, esențiale, ale pacientului de pe punga(ile) de perfuzare.
Decongelarea tisagenlecleucel și administrarea perfuziei trebuie sincronizate. Momentul de
începere a perfuzării trebuie confirmat în avans și ajustat în funcție de decongelare astfel încât
tisagenlecleucel să fie gata de administrare prin perfuzare atunci când pacientul este pregătit.
Odată decongelat și ajuns la temperatura ambientală (20°C-25°C), tisagenlecleucel trebuie
perfuzat în decurs de 30 minute pentru a menține nivelul maxim de viabilitate a medicamentului,
inclusiv orice întrerupere pe durata perfuzării.
Administrare
Tisagenlecleucel trebuie administrat prin perfuzare intravenoasă, printr-o tubulatură fără latex
pentru administrare intravenoasă, fără filtru de depleție leucocitară, la aproximativ 10 până la
20 ml pe minut, prin curgere gravitațională. Trebuie perfuzat conținutul integral al pungii(ilor) de
perfuzare. Pentru pregătirea tubulaturii, trebuie utilizată soluție de clorură de sodiu de 9 mg/ml
(0,9%) pentru injectare înainte de administrarea perfuziei și pentru clătire după administrarea
acesteia. După perfuzarea volumului complet de tisagenlecleucel, punga de perfuzare trebuie
clătită cu 10 până la 30 ml soluție de clorură de sodiu 9 mg/ml (0,9%), prin clătire inversă pentru
a asigura perfuzarea a cât mai multe celule la pacient.
Dacă volumul de tisagenlecleucel care va fi administrat este ≤20 ml, se poate utiliza injectarea
rapidă intravenos ca metodă alternativă de administrare.
V. MONITORIZAREA TRATAMENTULUI SI PRECAUTII:
• Pentru a asigura trasabilitatea, numele produsului, numărul lotului și numele pacientului
tratat trebuie păstrate pentru o perioadă de 30 ani.
• Nu trebuie efectuată perfuzarea decât după rezolvarea oricărora dintre afecțiunile de mai
jos.
– Reacții adverse grave nerezolvate (mai ales reacții pulmonare, cardiace sau
hipotensiune arterială) determinate de chimioterapii anterioare;
– Infecție activă necontrolată;
– Boală activă grefă-contra-gazdă (GVHD);
– Agravare clinică semnificativă a leucemiei după chimioterapia de limfodepleție.
• Trebuie asigurat tratament adecvat profilactic și terapeutic împotriva infecțiilor. Trebuie
asigurată rezolvarea completă a oricăror infecții existente.
• În cazul neutropeniei febrile, infecția trebuie evaluată și tratată în mod corespunzător cu
antibiotice cu spectru larg, lichide și alte măsuri de susținere, după cum este indicat din
punct de vedere medical.
• Pacienții tratați cu tisagenlecleucel nu trebuie să doneze sânge, organe, țesuturi sau celule.
• La 3 luni de la perfuzare se va evalua raspunsul la tratament definit ca raspuns complet
sau raspuns partial; pacientii cu raspuns partial se reevalueaza la 6 luni de la perfuzare in
vederea confirmarii/infirmarii obtinerii raspunsului complet
• Monitorizarea raspunsului la tratament al pacientilor dupa administrarea tisagenlecleucel
(prin metode imagistice, examen fizic, biopsie de maduva osoasa, evaluarea simptomelor
de tip B) se va efectua in ziua 28 apoi in lunile 3, 6, 9,12, 18 si 24 iar ulterior la fiecare 12
luni timp de pana la 5 ani
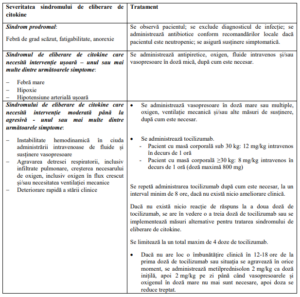
• Sindromul de eliberare de citokine
– Pacienții trebuie monitorizați îndeaproape pentru semne sau simptome ale sindromului
de eliberare de citokine ce pot include: febră crescută, rigiditate, mialgie, artralgie,
greață, vărsături, diaree, diaforeză, erupții cutanate tranzitorii, anorexie, fatigabilitate,
cefalee, hipotensiune arterială, dispnee, tahipnee, hipoxie, insuficiență cardiacă și
aritmie, insuficiență renală și insuficiență hepatică, însoțită de valori crescute ale
aspartat aminotransferazei (AST), valori crescute ale alanin aminotransferazei (ALT)
sau valori crescute ale bilirubinei totale; În unele cazuri, pot apărea coagulare
intravasculară diseminată (DIC), cu niveluri scăzute de fibrinogen, sindromul
scurgerilor la nivelul capilarelor (CLS), sindromul activării macrofagelor (MAS) și
limfohistiocitoză hemofagocitică (HLH) în contextul sindromului de eliberare de
citokine.
– Încărcătura tumorală accentuată anterior perfuzării tisagenlecleucel a fost identificată
ca factor de risc pentru dezvoltarea sindromului de eliberare de citokine sever la
pacienți adulți cu DLBCL.
– În aproape toate cazurile, apariția sindromului de eliberare de citokine a avut loc între
1 până la 10 zile (debut median în 3 zile) de la perfuzarea tisagenlecleucel. Timpul
median până la rezolvarea sindromului de eliberare de citokine a fost de 8 zile.
Algoritmul de management al sindromului de eliberare de citokine
– Sindromul de eliberare de citokine trebuie tratat exclusiv în funcție de tabloul clinic al
pacientului și conform algoritmului de management al sindromului de eliberare de citokine
furnizat în tabelul de mai jos.
– Terapia pe bază de anti-IL-6, cum este tocilizumab, a fost administrată în cazuri moderate
sau severe de sindrom de eliberare de citokine asociat cu tisagenlecleucel. O doză de
tocilizumab per pacient trebuie să fie la îndemână și disponibilă pentru administrare înainte
de perfuzarea tisagenlecleucel. Centrul de tratament trebuie să aibă acces la doze
suplimentare de tocilizumab în maximum 8 ore.
– În situații de urgență cu potențial letal, se pot administra corticosteroizi.
– Pentru tratarea sindromului de eliberare de citokine asociat cu administrarea
tisagenlecleucel nu se recomandă administrarea antagoniștilor factorului de necroză
tumorală (TNF).
Reacții adverse de natură neurologică
– Pacienții trebuie monitorizați cu privire la evenimente neurologice (encefalopatie, stare de
confuzie sau delir, nivel scăzut de conștiență, convulsii, afazie și tulburare de vorbire). În
cazul evenimentelor neurologice, pacienții trebuie diagnosticați și tratați în funcție de
fiziopatologia existentă și în conformitate cu protocoalele locale.
– Cele mai mult tipuri de evenimente neurologice au apărut în decurs de 8 săptămâni de la
administrarea perfuziei cu tisagenlecleucel și au fost tranzitorii. Timpul median până la
debutul primelor evenimentelor neurologice a fost de 6 zile în DLBCL. Timpul median
până la rezolvare a fost de 13 zile pentru DLBCL.
• Pacienții pot prezenta în continuare citopenie timp de câteva săptămâni după chimioterapia de
limfodepleție și perfuzarea tisagenlecleucel și trebuie tratați conform recomandărilor
standard. Nu se recomandă administrarea de factori de creștere mieloizi, mai ales factor de
stimulare a coloniei de celule macrofage (GM-CSF), care pot agrava simptomele sindromului
de eliberare de citokine, în decursul primelor 3 săptămâni după perfuzarea tisagenlecleucel
sau până la rezolvarea sindromului de eliberare de citokine.
• Pacienții tratați cu tisagenlecleucel trebuie monitorizați pe toată durata vieții pentru a se
identifica apariția neoplaziilor secundare.
• Nivelurile imunoglobulinei trebuie monitorizate după tratamentul cu tisagenlecleucel. La
pacienții cu niveluri scăzute de imunoglobulină, trebuie implementate măsuri de precauție,
cum sunt măsuri de precauție împotriva infecțiilor, profilaxie cu antibiotic și înlocuirea
imunoglobulinei în funcție de vârstă și în conformitate cu recomandările standard.
• Pentru a reduce la minimum riscul apariției sindromului lizei tumorale (TLS), pacienții cu
valori crescute ale acidului uric sau cu încărcare tumorală mare trebuie să administreze,
înainte de administrarea perfuziei cu tisagenlecleucel, alopurinol sau un medicament
profilactic alternativ. Semnele și simptomele TLS trebuie monitorizate și evenimentele
trebuie tratate în funcție de recomandările standard.
• Pacienții cu antecedente de tulburare activă a SNC sau insuficiență renală, hepatică,
pulmonară sau cardiacă necesită atenție specială.
• Nu se recomandă ca pacienților să li se administreze tisagenlecleucel în decurs de 4 luni de la
un transplant alogen cu celule stem (SCT) din cauza riscului potențial ca tisagenlecleucel să
agraveze GVHD. Leucafereza pentru fabricarea tisagenlecleucel trebuie efectuată la
minimum 12 săptămâni după SCT alogen.
• Screening-ul pentru HBV, HCV și HIV trebuie efectuat în conformitate cu recomandările
clinice înainte de recoltarea celulelor pentru fabricarea medicamentului. Reactivarea virusului
hepatitei B (HBV) poate avea loc la pacienții tratați cu medicamentele direcționate împotriva
celulelor B și pot determina apariția hepatitei fulminante, insuficienței hepatice și decesului.
• Nu se recomandă tisagenlecleucel dacă pacientul a prezentat recădere cu leucemie CD19-
negativă după tratament anterior anti-CD19.
• Datorită porțiunilor limitate și scurte de informații genetice identice între vectorul lentiviral
utilizat pentru a crea tisagenlecleucel și HIV, unele teste comerciale cu acid nucleic pentru
HIV (NAT) pot determina rezultate fals pozitive.
• Pacienții care nu au fost expuși anterior la dextran și dimetil sulfoxid (DMSO) trebuie
observați cu atenție în primele minute ale perioadei de administrare a perfuziei.
• Tisagenlecleucel nu este recomandat în timpul sarcinii şi la femei aflate la vârsta fertilă care
nu utilizează măsuri contraceptive.
VI. PRESCRIPTORI:
Tratamentul se prescrie si se administreaza de către medicii din specialitatea hematologie din
centrele calificate pentru administrare dupa obtinerea avizului Comisiei de terapii celuare a
Ministerului Sănătății. Pentru evaluarea indicatiei de tisagenlecleucel si aviz se va completa de
către medicul curant Anexa 1 si se va trimite catre Comisia de Terapii Celulare a Ministerului
Sănătății.
Anexa 1


A. ELEMENTE DE SUSȚINERE A DIAGNOSTICULUI

B. BILANȚUL ACTUAL

Ținând cont de tipul de boală și de evoluția acesteia, este de apreciat că la nivelul cunoștințelor
medicale actuale, acest pacient are șanse mai mari de supraviețuire prin efectuarea unui tratament
cu TISAGENLECLEUCEL:

C. DECIZIA COMISIEI DE TERAPII CELULARE A MINISTERULUI SANATATII

Avizul Comisiei de Terapii Celulare:

COMISIA DE TERAPII CELULARE A MINISTERULUI SANATAT
Cele mai noi stiri medicale:










