Protocol terapeutic
conform ordin MS/CNAS NR 564/499/2021
L01XE39 – DCI MIDOSTAURINUM
L01XE39 – DCI MIDOSTAURINUM
Citeste mai mult: https://www.formaremedicala.ro/l01xe39-dci-midostaurinum/
1. LEUCEMIE ACUTĂ MIELOIDA (LAM) CU MUTAȚIE FLT3
I. DEFINIŢIA AFECŢIUNII:
• leucemie acută mieloida (LAM) cu mutație FLT3
Această indicaţie se codifică la prescriere prin codul 162 (conform clasificării internaţionale a maladiilor revizia a
10-a, varianta 999 coduri de boală).
II. CRITERII DE INCLUDERE:
• Pacienții adulți nou diagnosticați cu leucemie acută mieloida (LAM), cu mutație FLT3 în asociere cu
chimioterapia standard de inducție cu daunorubicină/ antracicline și citarabină și de consolidare cu doză mare
de citarabină, iar la pacienții cu răspuns complet, ca tratament de întreținere cu midostaurin în monoterapie;
Înainte de administrarea midostaurin, pentru pacienții cu LAM trebuie să se obțină o confirmare a mutației FLT3
(duplicare tandem internă [ITD] sau în domeniul tirozin kinazei [TKD])
III. CONTRAINDICATII:
• Hipersensibilitate la substanța activă sau la oricare dintre excipienți
• Trebuie avută în vedere administrarea concomitentă de medicamente care nu inhibă puternic
activitatea CYP3A4. În cazul în care nu există alternative terapeutice satisfăcătoare, pacienții trebuie
monitorizați cu atenție pentru a se dipista apariția toxicităților legate de midostaurin
• Sarcina și alăptarea
IV. TRATAMENT (doze, condiţiile de scădere a dozelor, perioada de tratament):
Tratamentul cu midostaurin trebuie inițiat de către un medic cu experiență în utilizarea terapiilor antineoplazice.
Doze
Midostaurin trebuie administrat, pe cale orală, de două ori pe zi, la interval de aproximativ 12 ore. Capsulele
trebuie administrate împreună cu alimente, înghițite întregi, cu un pahar cu apă; nu trebuie deschise, sfărâmate
sau mestecate pentru a se asigura administrarea dozei adecvate și a se evita gustul neplăcut al conținutului
capsulei.
Trebuie administrate antiemetice în scop profilactic, în conformitate cu practica medicală locală și în funcție de
tolerabilitatea pacientului.
LAM
Doza recomandată este 50 mg de două ori pe zi, cu administrare pe cale orală.
Midostaurin se administrează în zilele 8-21 ale ciclurilor de chimioterapie de inducție și consolidare, iar ulterior,
la pacienții cu răspuns complet, în fiecare zi, ca monoterapie în tratamentul de întreținere, timp de până la
12 cicluri a câte 28 zile . La pacienții cu transplant de celule stem hematopoietice (TCS), administrarea de
Midostaurin trebuie întreruptă cu 48 ore înainte de schema de condiționare pentru TCS.
Modificările dozei în LAM
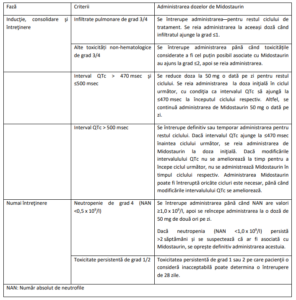
Recomandările privind modificarea dozelor la pacienții cu LAM sunt prezentate în Tabelul 1.
Tabelul 1- Recomandări privind întreruperea administrării dozei, reducerea dozei și oprirea definitivă a
administrării dozelor de Midostaurin la pacienți cu LAM
V. MONITORIZAREA TRATAMENTULUI SI PRECAUTII:
Fază Criterii Administrarea dozelor de Midostaurin
Inducţie, consolidare şi
întreţinere
Infiltrate pulmonare de grad 3/4 Se întrerupe administrarea pentru restul ciclului de
tratament. Se reia administrarea la aceeași doză când
infiltratul ajunge la grad ≤1.
Alte toxicități non-hematologice
de grad 3/4
Se întrerupe administrarea până când toxicitățile
considerate a fi cel puțin posibil asociate cu Midostaurin
au ajuns la grad ≤2, apoi se reia administrarea.
Interval QTc > 470 msec şi
≤500 msec
Se reduce doza la 50 mg o dată pe zi pentru restul
ciclului. Se reia administrarea la doza iniţială în ciclul
următor, cu condiţia ca intervalul QTc să ajungă la
≤470 msec la începutul ciclului respectiv. Altfel, se
continuă administrarea de Midostaurin 50 mg o dată pe
zi.
Interval QTc > 500 msec Se întrerupe definitiv sau temporar administrarea pentru
restul ciclului. Dacă intervalul QTc ajunge la ≤470 msec
înaintea ciclului următor, se reia administrarea de
Midostaurin la doza iniţială. Dacă modificările
intervalulului QTc nu se ameliorează la timp pentru a
începe ciclul următor, nu se administrează Midostaurin în
timpul ciclului respectiv. Administrarea Midostaurin
poate fi întreruptă oricâte cicluri este necesar, până când
modificările intervalulului QTc se ameliorează.
Numai întreţinere Neutropenie de grad 4 (NAN
<0,5 x 109
/l)
Se întrerupe administrarea până când NAN are valori
≥1,0 x 109
/l, apoi se reîncepe administrarea la o doză de
50 mg de două ori pe zi.
Dacă neutropenia (NAN <1,0 x 109
/l) persistă
>2 săptămâni și se suspectează că ar fi asociată cu
Midostaurin, se oprește definitiv administrarea acestuia.
Toxicitate persistentă de grad 1/2 Toxicitatea persistentă de grad 1 sau 2 pe care pacienţii o
consideră inacceptabilă poate determina o întrerupere
de 28 zile.
NAN: Număr absolut de neutrofile
• Numărul de leucocite trebuie monitorizat în mod regulat, mai ales la inițierea tratamentului.
• Orice infecție gravă activă trebuie să fie controlată înainte de inițierea tratamentului cu Midostaurin în
monoterapie. Pacienții trebuie monitorizați pentru a se identifica semnele și simptomele infecțiilor,
inclusiv orice infecții asociate dispozitivelor și, dacă se stabilește un diagnostic de infecție, trebuie
instituit promp tratament adecvat, inclusiv, dacă este necesar, oprirea definitivă a administrării
Midostaurin.
• În cazul pacienților cu risc cardiac, Midostaurin trebuie utilizat cu precauție iar aceștia trebuie
monitorizați îndeaproape prin evaluarea FEVS, când este clinic indicat (la momentul inițial și în timpul
tratamentului).
• Trebuie avute în vedere evaluări ale intervalului QT prin intermediul EKG dacă Midostaurin este
administrat concomitent cu medicamente care pot prelungi intervalul QT.
• Pacienții trebuie monitorizați pentru a se identifica simptomele pulmonare care indică boala pulmonara
interstitiala (BPI) sau pneumonită și tratamentul cu Midostaurin trebuie oprit definitiv la pacienții care
prezintă simptome pulmonare care indică BPI sau pneumonită de grad ≥3 (NCI CTCAE).
• Femeile aflate la vârsta fertilă trebuie să facă un test de sarcină cu 7 zile înainte de începerea
tratamentului cu midostaurin și să utilizeze metode contraceptive eficace în timpul tratamentului și timp
de minimum 4 luni de la întreruperea tratamentului. Femeile care utilizează contraceptive hormonale
trebuie să folosească în plus o metodă de contracepție de tip barieră.
• Din cauza posibilelor reacții adverse grave la sugarii alăptați, cauzate de midostaurin, femeile trebuie să
întrerupă definitiv alăptarea în timpul tratamentului și timp de minimum 4 luni de la întreruperea
tratamentului
• Precautii si monitorizare atenta la pacienții cu insuficiență hepatică severă , insuficiență renală severă
sau boală renală în stadiu terminal.
VI. PRESCRIPTORI:
Iniţierea și continuarea tratamentului se face de către medicii din specialitatea hematologie.”
2. MASTOCITOZA SISTEMICĂ
l. Indicaţia terapeutică: Mastocitoza Sistemica (MS)
Exclusiv in scopul identificarii si raportarii pacientilor efectiv tratati pe aceasta indicatie, indiferent de criteriile
de includere in tratament, se codifică la prescriere prin codul 166 (conform clasificării internaţionale a maladiilor
revizia a 10-a, varianta 999 coduri de boală).
Diagnosticul mastocitozei sistemice
Criteriul major de diagnostic pentru mastocitoza sistemică:
Infiltrate multifocale dense de mastocite în măduva osoasă și/sau în alte organe extracutanate (> 15 mastocite
în agregat).
Criteriile minore de diagnostic pentru mastocitoza sistemică:
• Peste 25% dintre mastocite în măduva osoasă au anomalii morfologice de tip I sau II sau sunt fuziforme
în alte organe extracutanate ;
• Mutaţii activatoare ale c-kit (D816 sau altele) la nivelul mastocitelor din măduva osoasă sau din alte
ţesuturi;
• Mastocite în sânge, măduva osoasă sau în alte organe extracutanate ce exprimă aberant CD25 și/sau
CD2;*
• Cantitate totală de triptază din ser > 20 ng/ml persistentă (fără aplicabilitate la pacienţii cu o boală
hematologică mieloidă asociată).
Se consideră mastocitoza ca sistemică dacă se îndeplineste 1 criteriu major şi 1 criteriu minor, sau 3 criterii
minore.
CRITERII DE SEVERITATE ÎN MASTOCITOZE, clasificate ca semne “B” şi “C”.
Semne “B”: apreciază nivelul crescut de încarcătură cu mastocite și expansiunea neoplazică în linii multiple
hematopoietice fără evidențierea leziunilor de organ.
1. biopsie de măduvă osoasă cu > 30% infiltrare de mastocite (focal, agregate dense) prin histologie (și / sau >
1% prin citometrie în flux) și nivelul seric al triptazei > 200 μg /l
2. semne discrete de dismielopoieză în celule de linie non-mastocitară fără citopenie semnificativă, și criterii
OMS insuficiente pentru diagnostic de sindrom mielodisplazic (SMD) sau neoplazie mieloproliferativă (NMP)
3. organomegalie (hepatomegalie, splenomegalie și / sau limfadenopatie > 2 cm pe CT sau ecografie) fără
insuficiență de organe.
Semne “C”:
Apreciează insuficiența de organe din cauza infiltrării cu mastocite (confirmată prin biopsie dacă este posibil).
1. citopenie (neutrofile <1,0 · 109 / l, hemoglobină <10 g/dl și / sau trombocite <100 · 109
/l), datorită disfuncției
medulare, fără alte celule hematopoietice non-mastocitare cu semne de malignitate
2. hepatomegalie cu insuficiență hepatică și/sau ascită și/sau hipertensiune portală
3. splenomegalie – splină palpabilă cu hipersplenism
4. malabsorbţie cu hipoalbuminemie și pierdere în greutate
5. leziuni osteolitice semnificative și/sau fracturi patologice asociate cu infiltrare locală cu mastocite
ll. Criterii de includere în tratament
Midostaurin se administreaza in monoterapie la pacientii adulti cu:
– Mastocitoza sistemica agresiva (MSA),
– mastocitoza sistemica cu neoplazie hematologica asociata(MS-NHA)
– leucemie cu mastocite (LCM)
MS-NHA= MS cu semne displazice sau proliferative in tesutul hematopoietic
MSA= MS cu cel putin 1 semn C
LCM= peste 20% mastocite maligne in maduva osoasa
lll. Contraindicatii
– Hipersensibilitate la medicament sau oricare dintre excipienti
– Administrarea concomitentă a inductorilor potenți ai CYP3A4, de exemplu, rifampicină, sunătoare
(Hypericum perforatum), carbamazepină, enzalutamid, fenitoină
lV. Tratament (doze, condiţiile de scădere a dozelor, perioada de tratament):
Tratamentul cu midostaurin trebuie initiat de către un medic cu experiență în gestionarea pacienților cu
afecțiuni hematologice.
Doze
Administrare orala, doza este de 100 mg la 12 ore, odata cu ingestia de alimente.
Se pot administra antiemetice in conformitate cu recomandarile medicului curant.
Tratamentul se continua atata timp cat exista beneficiu clinic, sau pana la aparitia toxicitatii inacceptabile.
Doze omise
Dacă se omite o doză, pacientul trebuie să ia doza următoare la ora programată.
Dacă apar vărsăturile, pacientul nu trebuie să ia o doză suplimentară de midostaurin, ci trebuie să ia următoarea
doză programată.
Grupe speciale de pacienți
Vârstnici (≥65 ani)
Nu este necesară ajustarea schemei terapeutice la pacienții cu vârsta peste 65 ani.
Insuficiență renală
Nu este necesară ajustarea dozei la pacienții cu insuficiență renală ușoară până la moderată. Experiența clinică
la pacienții cu insuficiență renală severă este limitată și nu sunt disponibile date la pacienții cu boală renală în
stadiu terminal.
Insuficiență hepatică
Nu este necesară ajustarea dozei la pacienții cu insuficiență hepatică ușoară până la moderată (clasă Child-Pugh
A sau B). Nu au fost efectuate studii la pacienții cu insuficiență hepatică severă (clasă Child-Pugh C).
Copii și adolescenți
Siguranța și eficacitatea midostaurin la copii și adolescenți cu vârsta sub 18 ani nu au fost stabilite, si nu se poate
face nicio recomandare privind dozele.
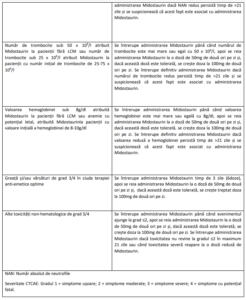
Recomandări privind întreruperea administrării dozei, reducerea dozei și oprirea definitivă a administrării
dozelor de Midostaurin la pacienți cu MSA, MS-NHA sau LCM

V. Atenționări și precauții speciale pentru utilizare
• Neutropenie și infecții
Numărul de limfocite trebuie monitorizat în mod regulat, mai ales la inițierea tratamentului. La pacienții care
dezvoltă neutropenie severă inexplicabilă, tratamentul cu midostaurin trebuie întrerupt sau oprit definitiv la
pacienții care dezvoltă neutropenie severă recidivantă sau prelungită, care este suspectată a fi asociată cu
administrarea
Orice infecție gravă activă trebuie să fie controlată înainte de inițierea tratamentului Pacienții trebuie
monitorizați pentru a se identifica semnele și simptomele infecțiilor, inclusiv orice infecții asociate dispozitivelor
și, dacă se stabilește un diagnostic de infecție, trebuie instituit prompt tratament adecvat, inclusiv, dacă este
necesar, oprirea definitivă a administrării midostaurinului.
• Disfuncție cardiacă
Pacienții cu insuficiență cardiacă congestivă simptomatică au fost excluși din studiile clinice. În cazul pacienților
cu risc, midostaurin trebuie utilizat cu precauție, iar aceștia trebuie monitorizați îndeaproape prin evaluarea
FEVS, când este clinic indicat (la momentul inițial și în timpul tratamentului). La pacienții care prezintă risc de
prelungire a intervalului QTc (de exemplu, din cauza administrării concomitente a altor medicamente și/sau
tulburări electrolitice) trebuie luate măsuri de precauție. Trebuie avute în vedere evaluări ale intervalului QT
prin intermediul EKG dacă midostaurin este administrat concomitent cu medicamente care pot prelungi
intervalul QT.
• Toxicitate pulmonară
Pacienții trebuie monitorizați pentru a se identifica simptomele pulmonare care indică BPI sau pneumonită și
tratamentul cu midostaurin trebuie oprit definitiv la pacienții care prezintă simptome pulmonare care indică BPI
sau pneumonită de grad ≥3 (NCI CTCAE).
• Toxicitate embriofetală și alăptare
Femeile gravide trebuie informate cu privire la riscul posibil pentru făt; femeile aflate la vârsta fertilă trebuie
sfătuite să facă un test de sarcină cu 7 zile înainte de începerea tratamentului și să utilizeze metode
contraceptive eficace în timpul tratamentului și timp de minimum 4 luni de la întreruperea tratamentului.
Femeile care utilizează contraceptive hormonale trebuie să folosească în plus o metodă de contracepție de tip
barieră. Din cauza posibilelor reacții adverse grave la sugarii alăptați, femeile trebuie să întrerupă definitiv
alăptarea în timpul tratamentului și timp de minimum 4 luni de la întreruperea tratamentului.
• Insuficiență hepatică severă
Trebuie luate măsuri de precauție când se are în vedere administrarea midostaurin la pacienții cu insuficiență
hepatică severă. Pacienții trebuie monitorizați cu atenție, pentru a se identifica apariția toxicității.
• Insuficiență renală severă
Trebuie luate măsuri de precauție când se are în vedere administrarea midostaurin la pacienții cu insuficiență
renală severă sau boală renală în stadiu terminal. Pacienții trebuie monitorizați cu atenție pentru a se identifica
apariția toxicității.
• Interacțiuni
Trebuie luate măsuri de precauție când se prescrie administrarea de midostaurin concomitent cu medicamente
care sunt inhibitori potenți ai CYP3A4, cum sunt următoarele și nu numai: antifungice (de exemplu,
ketoconazol), anumite antivirale (de exemplu, ritonavir), antibiotice macrolide (de exemplu, claritromicină) și
nefazodon, dat fiind că acestea cresc concentrațiile plasmatice ale midostaurin, mai ales când se re(ia)
tratamentul cu midostaurin. Trebuie avută în vedere administrarea concomitentă de medicamente care nu
inhibă puternic activitatea CYP3A4. În cazul în care nu există alternative terapeutice satisfăcătoare, pacienții
trebuie monitorizați cu atenție pentru a se depista apariția toxicităților legate de midostaurin.
Excipienți
Medicamentul conține hidroxistearat de macrogolglicerol, care poate determina apariția disconfortului stomacal
și diareei.
O doză de 100 mg de medicament conține aproximativ 14 vol. % etanol, care corespunde cu 333 mg alcool.
Acesta este echivalentul a 8,4 ml de bere sau 3,5 ml de vin. Alcoolul poate fi nociv la pacienții cu probleme
legate de consumul de alcool, epilepsie sau probleme hepatice sau în timpul sarcinii sau alăptării.
Vl. Criterii pentru întreruperea tratamentului cu Midostaurin: lipsa de răspuns, apariția unor toxicități
inacceptabile sau intoleranță.
Pentru lipsa de răspuns recomandăm criteriile de răspuns IWG-MRT-ECNM:
– pierderea răspunsului – pierderea răspunsului complet (RC), răspuns parțial (RP), îmbunătățire clinică
(ÎC) timp de peste 8 săptămâni.
– RC toate cele 4 criterii cel puțin 12 săptămâni:
o lipsa agregatelor de mastocite maligne în măduva osoasă sau alt organ extracutanat
o triptaza serică < 20 ng/ml
o remisiune hematologică periferică cu neutrofile > 1 x 109
/l, cu formula leucocitară normală, Hb >
11 g/dl, trombocite > 100 x 109
/l
o hepatosplenomegalie sau alte leziuni de organ complet remise demonstrate prin biopsie
– RP toate cele 3 criterii cel puțin 12 săptămâni în absența RC și progresiei de boală (PB):
o Reducerea cu > 50% a infiltrării neoplazice cu mastocite în maduva osoasă si/sau alt organ
extracutanat demonstrată prin biopsie
o Reducerea nivelului triptazei serice cu > 50% (dacă înainte de tratament depășește 40 ng/ml)
o Rezoluția a cel puțin unei leziuni de organ demonstrate bioptic (semn C)
– ÎC cu durata de răspuns cel puțin 12 săptămâni:
o Necesită cel puțin un criteriu de răspuns nonhematologic sau/și hematologic în absența RC/RP
sau PB.
Vll. Prescriptori: Iniţierea se face de către medicii din specialitatea hematologie medicală. Continuarea
tratamentului se face de către medicul hematolog.
Cele mai noi stiri medicale: