Protocol terapeutic
conform ordin MS/CNAS NR 702/133/2022
L01XE31 – DCI NINTEDANIBUM (OFEV)
L01XE31 – DCI NINTEDANIBUM (OFEV)
Citeste mai mult: https://www.formaremedicala.ro/l01xe31-dci-nintedanibum-ofev/
I. Indicaţii terapeutice:
Pneumopatii interstițiale difuze – fenotip fibrozant progresiv (PID-FFP) la adulţi (cu
excepția Fibrozei pulmonare idiopatice – Protocol terapeutic L014AE – C2-P6.20).
a. Diagnostic:
Pneumopatia interstițială difuză – fenotipul fibrozant progresiv reprezintă un grup divers
de pneumopatii interstițiale difuze (PID) care au caracteristici similare din punct de vedere
genetic, fiziopatologic și clinic și care sunt caracterizate de o evoluție fibrozantă, progresivă.
Acest fenotip poate fi observat în numeroase subtipuri de PID:
• Pneumonita de hipersensibilitate – forma cronică, fibrozantă;
• Pneumopatie interstițială difuză – formă nespecifică idiopatică (iNSIP), fibrozantă;
• Pneumopatie interstițială neclasificabilă, fibrozantă;
• Pneumopatie interstițială difuză cu fenomene autoimune, fibrozantă;
• Sarcoidoza cu afectare interstițială pulmonară fibrozantă, progresivă;
• Colagenozele cu afectare interstițială difuză progresivă (de exemplu: poliartrita
reumatoidă, boala mixtă de țesut conjunctiv, scleroza sistemică,
polimiozită/dermatomiozită, sindrom Sjogren, sindrom antisintetazic, lupusul eritematos
sistemic, etc.)
• Fibroza pulmonară familială și/sau genetică;
• Fibroelastoza pleuro-pulmonară;
• Pneumopatiile interstițiale difuze fibrozante progresive induse de medicamente;
• Pneumopatiile interstițiale difuze fibrozante progresive induse de expunerea profesională
(silicoză, azbestoză, etc.);
• Alte tipuri de PID fibrozante.
Diagnosticul de PID-FFP este susținut de următoarele:
• Simptome: de obicei pacienții acuză tuse seacă progresivă, dispnee progresivă de efort,
toleranță scăzută la efort;
• Semne clinice: auscultația pulmonară poate pune în evidență raluri crepitante fine sau „in
velcro”, anomalii articulare sau cutanate (în colagenoze), uneori hipocratism digital;
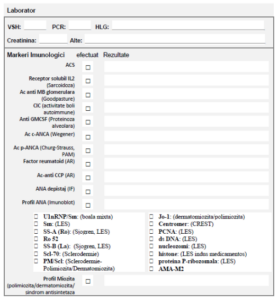
• Serologie: prezența autoanticorpilor circulanți poate susține un diagnostic de colagenoză;
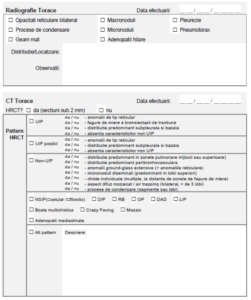
• Radiologie: tomografia computerizată cu rezoluție înaltă (high resolution computed
tomography, HRCT) poate evidenția leziuni de tip interstițial ce modifică arhitectura
normală a plămȃnului:
– opacități de tip reticular, bronșiectazii/bronșiolectazii de tracțiune cu sau fără leziuni
de „fagure de miere” sau
– opacități de tip „geam mat”/condensare alveolară cu opacități de tip reticular și
bronșiectazii/bronșiolectazii de tracțiune suparaadăugate.
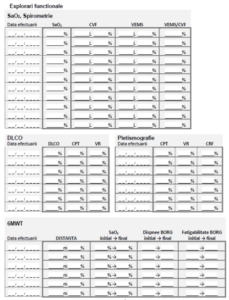
• Probele funcționale respiratorii: scăderea CVF cu raport VEMS/CVF normal sau
crescut peste valoarea inferioară limită a normalului (lower limit normal, LLN), scăderea
CPT, scăderea VR, scăderea factorului de transfer al CO (DLco). De obicei acestea se
intălnesc în disfuncțiile ventilatorii de tip restrictiv;
• Proceduri suplimentare: lavajul bronhiolo-alveolar (LBA), ecografia endobronșică cu
puncție-biopsie transbronșică ganglionară, biopsia pulmonară transbronșică, criobiopsia
transbronșică sau biopsia pulmonară chirurgicală, testul de mers 6 minute, testul de efort
cardio-pulmonar pot fi utilizate la nevoie în stabilirea unui diagnostic de certitudine.
Discuția multidisciplinară reprezintă standardul de aur în diagnosticul PID-FFP. La aceasta
participă medici specialiști pneumologi, reumatologi, radiologi și anatomo-patologi (după
caz).
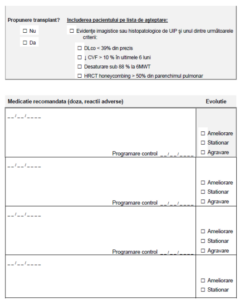
b. Progresivitatea fibrozei poate fi evidențiată pe unul din următoarele:
• pe HRCT – progresia leziunilor de tip fibrotic în ultimele 3-24 luni însoțită de agravarea
simptomelor respiratorii (de exemplu aprecierea gradului de dispnee pe scala mMRC –
modified Medical Research Council) sau scăderea CVF ≥ 5% din valoarea prezisă; SAU
• scăderea CVF cu ≥ 10% din valoarea prezisă în ultimele 3-24 de luni; SAU
• scăderea CVF ≥ 5% din valoarea prezisă și agravarea simptomelor în ultimele 3-24 luni;
SAU
• scăderea factorului de transfer cu ≥ 15% în ultimele 3-24 de luni; SAU
• testul de mers 6 minute cu scăderea distanței parcurse cu >50 metri în ultimele 3-24 luni
SAU desaturarea semnificativă (cel putin 4%).
Evaluarea progresivității PID-FFP va fi stabilită de medicul specialist pneumolog. In cazul
colagenozelor sau pneumopatiei interstitiale difuze cu fenomene autoimune progresivitatea
PID-FFP va fi stabilită împreună cu medicul reumatolog.
II. Criterii pentru includerea unui pacient în tratament
1. Criterii de includere în tratamentul cu nintedanib (criteriul d. se aplică după caz):
a. Adult (>18 ani);
b. Diagnostic de pneumopatie interstițială difuză – fenotip fibrozant progresiv;
c. Obiectivarea progresivității fibrozei;
d. Răspunsul insuficient la tratamentul de primă linie (dacă acesta există sau este
aplicabil), de exemplu:
– tratamentul cortizonic (singur sau în asociere cu imunosupresoare) în sarcoidoză;
– evitarea expunerii la agentul etiologic și tratament cortizonic în pneumonita de
hipersensibilitate;
– tratamentul cortizonic/imunosupresor în colagenozele cu afectare interstițială
pulmonară.
2. Criterii de excludere:
a. Intoleranță la nintedanibum sau excipienți, arahide sau soia
b. Sarcină în evoluție sau alăptare; persoanele de sex feminin de vârstă fertilă trebuie să
folosească un sistem de contracepție eficient.
c. Insuficiența hepatică moderată sau severă (Clasa Child-Pugh B, C) sau anomalii
biologice hepatice (ALAT sau ASAT > 3 X N)
d. Insuficiența renală severă (clearance-ul creatininei < 30 ml/min) sau boală renală
terminală care necesită dializă
e. Utilizare concomitentă cu ketoconazol, eritromicină, ciclosporină
III. Tratamentul cu nintedanibum:
Doze: Doza uzuală este de 1 cp a 150 mg de două ori pe zi, la interval de aproximativ 12 ore,
fără necesitatea titrării dozei la inţierea tratamentului. Capsulele trebuie administrate cu
alimente, înghiţite întregi, cu apă şi nu trebuie mestecate sau zdrobite.
Doza zilnică de 100 mg de două ori pe zi este recomandată a fi utilizată numai la pacienţii
care nu tolerează doza zilnică de 150 mg de două ori pe zi. Dacă este omisă o doză,
administrarea trebuie reluată cu următoarea doză recomandată, conform programului de
administrare, pacientul nu trebuie să utilizeze o doză suplimentară. Doza zilnică maximă
recomandată de 300 mg nu trebuie depăşită.
Durata tratamentului: Nintedanibum se administrează pe o perioadă nedefinită. Tratamentul
va fi oprit în caz de efecte secundare semnificative care nu răspund la scăderea dozei precum
sau în cazul în care medicul curant consideră că tratamentul nu este eficient.
Efecte secundare. Medicul curant este obligat să informeze pacientul asupra potenţialelor
efecte secundare şi de a obţine confirmarea în scris a acestei informări.
IV. Contraindicaţii:
• Hipersensibilitate la nintedanibum, excipienţi, arahide sau soia;
• Insuficienţa hepatică moderată și severă (Clasa Child-Pugh B sau C) sau anomalii
biologice hepatice (ALAT sau ASAT > 3 X N);
• Insuficienţa renală severă (clearance-ul creatininei < 30 ml/min);
• Afecțiuni congenitale cu risc hemoragic;
• Sindroame de hipocoagulabilitate congenitale;
• Accident vascular cerebral recent;
• Ischemie miocardică acută (dacă pacientul se află în perioada de tratament cu
nintedanibum se întrerupe administrarea);
• Perforația gastrică sau intestinală (nu se permite reluarea tratamentului).
V. Atenționări și precauții speciale pentru utilizare:
• Monitorizarea cardiologică atentă a pacienților cu interval QT lung;
• Se oprește tratamentul cu nintedanibum înaintea oricarei intervenții chirurgicale și se
poate relua după minim 4 săptămâni postoperator, dacă pacientul este considerat vindecat;
• Au fost raportate cazuri de hemoragie în perioada ulterioară punerii pe piață (inclusiv la
pacienți cu sau fără tratament cu anticoagulante sau cu alte medicamente care ar putea
cauza hemoragie). Prin urmare, acestor pacienți trebuie să li se administreze tratament cu
nintedanibum numai dacă beneficiul prevăzut depășește riscul potential.
Tratamentul cu nintedanibum poate fi asociat cu corticosteroizi, imunosupresoare sau alte
tipuri de medicamente adaptate fiecărui pacient în parte.
VI. Monitorizarea tratamentului.
Este obligaţia medicului curant. Ea constă în:
• Evaluare clinică şi biologică (transaminaze, bilirubină, fosfataza alcalină) cel puţin o dată
pe lună în primele 6 luni apoi minim o dată la trei luni;
• Evaluare funcțională respiratorie la 3-6 luni (minim spirometrie şi DLco);
• Evaluare imagistică – cel puţin o dată la 2 ani prin examen HRCT.
VII. Criterii pentru întreruperea tratamentului
Oprirea tratamentului cu nintedanibum:
• Decizia pacientului de a întrerupe tratamentul contrar indicaţiei medicale.
• Decizia medicului de întrerupere a tratamentului în cazul intoleranţei la tratament care nu
răspunde la scăderea dozei sau în cazul unui efect considerat insuficient.
• Refuzul pacientului de a efectua investigațiile necesare monitorizarii PID-FFP (vezi
paragraful monitorizare).
VIII. Prescriptori
Tratamentul va fi inițiat, continuat si monitorizat de medicii in specialitatea penumologie si
reumatologie.
Modalităţi de prescriere:
Medicul curant va întocmi un dosar ce va consta în:
1. Istoricul clinic al pacientului (ce va prezenta detalii asupra criteriilor de includere /
excludere);
2. Raportul HRCT însoţit de imagini pe CD sau stick de memorie;
3. Raportul anatomo-patologic (dacă este cazul);
4. Explorare funcţională respiratorie (minim spirometrie şi DLco);
5. Alte investigaţii care să certifice îndeplinirea criteriilor de includere/excludere;
6. Declaraţie de consimţământ informat a pacientului privind tratamentul recomandat
(Anexa nr.1)*;
7. Fișa pacientului cu PID-FFP (Anexa nr. 2).
*Consimţământul informat este obligatoriu la iniţierea tratamentului, precum şi pe parcursul acestuia, dacă
pacientul trece în grija altui medic curant. Medicul curant are obligaţia de a păstra originalul consimţământului
informat, care face parte integrantă din dosarul pacientului.
Anexa nr. 1
CONSIMŢĂMÂNT INFORMAT AL PACIENTULUI CU PNEUMOPATIE
INTERSTIŢIALĂ DIFUZĂ – FENOTIP FIBROZANT PROGRESIV
Subsemnatul/Subsemnata…………………………………..………….
CNP…….……………
Domiciliat/ă în localitatea …………………….………….., Str……………………………..,
nr ………., bl……..…, sc …….., et …..…., ap ……….., sector/judeţ
……………….……………., telefon ……………..………………,
având diagnosticul de …………………………………………………………………………..
declar că sunt de acord să urmez tratamentul cu Nintedanibum.
Aţi fost diagnosticat/diagnosticată de către medicul dumneavoastră curant cu pneumopatie
interstițială difuză – fenotip fibrozant progresiv (PID-FFP). Aceasta este o boală cronică,
caracterizată prin îngroşarea/cicatrizarea ţesutului pulmonar. Această îngroșare cuprinde
pereții alveolelor, ceea ce îngreunează intrarea oxigenului în sânge. Oxigenul insuficient și
plămânul modificat duc la respirație grea (la început mai ales la efort) și tuse seacă.
Această boală are nevoie de multe teste pentru a obține un diagnostic corect și necesită
urmărire permanentă. Cele mai importante investigații sunt: computerul tomograf cu înaltă
rezoluție, explorarea funcțională respiratorie complexă (inclusiv cu factor de transfer prin
membrana alveolo-capilară), gazometria, testul de mers 6 minute, bronhoscopia cu lavaj
bronhiolo-alveolar și chiar biopsia pulmonară (aceste investigații variază de la caz la caz).
Fiecare pacient diagnosticat cu această boală are o evoluție unică a bolii: cu perioade de
stabilitate, alții cu agravare rapidă a bolii sau cu agravare lentă in timp. Sunt lucruri pe care le
poți face pentru a menține starea de bine: oprirea fumatului, vaccinarea antigripală,
antipneumococică și antiSARS-CoV2, menținerea unei greutăți adecvate, urmărirea saturației
sângelui la domiciliu cu ajutorul unui dispozitiv numit pulsoximetru (se fixează pe deget și
măsoară saturația oxigenului care ar trebui sa fie peste 90%). Dacă această saturație scade la
valori la care medicul dumneavoastră consideră necesar, se poate suplimenta nivelul de
oxigen prin oxigenoterapie cronică la domiciliu. Boala dumneavoastră poate evolua sever si
poate necesita, la un moment dat, transplant pulmonar.
Medicamentul despre care discutăm în acest consimțământ a fost dovedit eficient în această
boală, el putând stopa declinul bolii și prelungi viața.
Pentru a putea lua acest medicament trebuie sa cunoașteți riscurile si beneficiile pentru a
putea lua o decizie in cunoștință de cauză. Acest proces este cunoscut sub denumirea de
“consimțământ exprimat in cunoștință de cauză”. Citiți cu atenție informațiile si discutați-le
cu oricine doriți. Aceasta persoană poate fi o rudă sau un prieten apropiat. Daca aveți
întrebări, adresați-vă medicului pneumolog sau asistentei medicale specializate. Odată ce veți
fi informat despre riscurile și beneficiile acestui tratament și despre analizele și controalele
necesare pentru a putea beneficia în continuare de el, veți fi rugat să semnați acest formular de
consimțământ exprimat în cunoștință de cauză pentru a vă putea include în program. Decizia
dumneavoastră de a lua acest tratament este voluntară. Acest lucru înseamnă ca puteți urma
acest tratament dacă doriți sau puteți să refuzați dacă nu doriți. Acordul sau refuzul de a urma
acest tratament prin program nu vă va afecta îngrijirea medicală. De asemenea, puteți opri
tratamentul și activitățile legate de el în orice moment, fără justificare. Daca alegeți să nu
urmați acest tratament puteți discuta cu medicul dumneavoastră despre îngrijirea medicală
obișnuită sau despre alte tratamente pentru PID-FFP.
Dacă, în orice moment în timpul tratamentului, manifestați orice simptome neobișnuite,
vă rugăm să vă adresați medicului pneumolog sau asistentei specializate.
Este posibil ca pe parcursul tratamentului să aflăm lucruri noi pe care trebuie să le cunoașteți.
De asemenea, putem afla eventualele motive pentru care ați putea opri tratamentul. În acest
caz, veți fi informat cu privire la orice date noi. Puteți decide, apoi, dacă doriți să luați în
continuare tratamentul. Medicul pneumolog poate decide oprirea tratamentului din orice
motiv justificat. Iată câteva exemple de motive pentru care ar trebui sa întrerupeți tratamentul:
• Tratamentul nu este eficient
• Continuarea administrării tratamentului ar fi nocivă pentru dumneavoastră
• Nu respectați instrucțiunile
• Rămâneți însărcinată
• Programul este anulat
Dacă hotărați să opriți tratamentul și controalele necesare, trebuie să comunicați acest lucru
medicului pneumolog.
Tratamentul prescris prin acest program se numește Nintedanib. Denumirea comercială a
medicamentul este Ofev. Este o capsulă gelatinoasă, moale, de culoarea piersicii cea de 100
mg și de culoare maro cea de 150 mg. Fiecare capsulă poate conține 100 mg și respectiv 150
mg de nintedanib. Tratamentul acesta trebuie inițiat si supravegheat de medici specialiști
pneumologi sau reumatologi. Trebuie sa luați acest tratament conform instrucțiunilor și nu
trebuie folosit la nimic altceva.
Doza zilnică este de 150 mg de două ori pe zi. Dacă această doză nu este tolerata, se
recomandă 100 mg de două ori pe zi. Nintedanibul se administrează pe o perioadă nedefinită.
În caz de reacții adverse, dozele pot fi ajustate sau oprite temporar pȃnă la dispariția reacției.
Dacă tratamentul cu 100 mg de doua ori pe zi nu poate fi tolerat, atunci tratamentul se oprește.
Capsulele trebuie luate cu alimente, înghițite întregi, cu apă si nu trebuie mestecate sau
zdrobite.
Se contraindică acest medicament daca aveți hipersensibilitate la nintedanib, arahide sau soia.
Reacții adverse posibile:
• Reacții găsitor-intestinale: greață, vărsături, diaree. Este importantă administrarea
medicației împreuna cu alimentația. Personalul medical trebuie anunțat pentru
scăderea dozelor sau oprirea momentană a medicației și reintroducerea ei după
dispariția simptomelor.
• Afectarea funcției ficatului: în cazul creșterii valorilor enzimelor de citoliză hepatică
(TGO, TGP), fosfataza alcalină, gama glutamiltransferaza cu sau fără creșterea valorii
bilirubinei, trebuie anunțat medicul curant și acesta va lua decizia ajustării/opririi
tratamentului conform recomandărilor. Dacă aveți insuficiență hepatică doza poate fi
redusă sau nu poate fi luat deloc acest medicament, în funcție de decizia medicului.
Datorită acestei posibile reacții adverse sunt necesare analize ale funcției hepatice
înainte de începerea tratamentului și ulterior periodic.
• Hemoragia: administrarea acestui medicament se poate asocia cu un risc crescut de
hemoragie. Trebuie sa anunțați medicul înainte de începerea tratamentului daca luați
medicamente anticoagulante (pentru “subțierea sângelui”).
• Evenimente tromboembolice arteriale: Se impune prudență la administrarea
medicamentului dacă aveți risc cardiovascular crescut. Se poate chiar întrerupe
tratamentul dacă apar semne și simptome de ischemie miocardică acută: durere sau
presiune la nivelul pieptului, durere la nivelul gȃtului, maxilarului, umărului, brațului,
bătăi rapide ale inimii, respirație dificilă, greață, vărsături.
• Tromboembolie venoasă: din cauza mecanismului de acțiune al medicamentului ar
putea fi un risc crescut. Anunțați medicul daca aveți durere, umflare, înroșire, senzație
de căldura la nivelul unui membru.
• Perforații găsitor-intestinale: din cauza mecanismului de acțiune al medicamentului
ar putea fi un risc crescut de perforație gastro-intestinală. Anunțați medicul dacă ați
avut o intervenție chirurgicală recentă în zona abdominală, medicamentul trebuie
administrat la peste o lună. De asemenea trebuia anunțat medicul în caz de durere
severă la nivelul abdomenului, febră, vărsături, rigiditate abdominală.
• Hipertensiune arterială: deoarece acest medicament poate creşte tensiunea arterială,
se recomandă măsurarea tensiunii arteriale periodic. De asemenea se impune prudență
dacă aveți intervalul QTc prelungit.
• Complicații ale vindecării plăgilor: din cauza mecanismului de acțiune al
medicamenului, vindecarea plăgilor poate fi afectată.
• Reacții alergice: anunțați medicul daca aveți alergie cunoscută la soia sau arahide.
Alte atenționări:
– Poate provoca afectare fetală la om. Dacă sunteți femeie la vârsta fertilă, trebuie sa
evitați să rămâneți însărcinată pe perioada tratamentului prin măsuri contraceptive
adecvate (inclusiv metode contraceptive de barieră, deoarece nu a fost investigat
efectul nintedanibului asupra eficacității contraceptivelor orale);
– Are influență mică asupra capacitații de a conduce vehicule sau de a folosi utilaje, de
aceea se recomandă prudență;
– Ar putea produce trombocitopenie;
– Poate interacționa cu alte medicamente: ketoconazol, eritromicină, ciclosporină,
rifampicină, carbamazepină, fenitoină, sunătoare etc. Trebuie anunțat medicul în cazul
administrării altor medicamente.
Monitorizarea tratamentului se va efectua:
– Examen clinic și analize de sânge periodic conform indicațiilor;
– Probe funcționale respiratorii la interval de 3-6 luni;
– Computer tomograf de înalta rezoluție cel puțin o dată la 2 ani.
Am fost informat asupra importaței și consecințelor administrării acestei terapii.
Am fost informat că există o probabilitate ca tratamentul să nu fie eficace.
Declar că sunt de acord cu instituirea acestui tratament și cu toate examenele clinice și de
laborator necesare unei conduite terapeutice eficace.
Declar că sunt de acord să urmez instrucțiunile medicului, să răspund la întrebări și să
semnalez în timp util orice manifestare clinică survenită pe parcursul terapiei.
Mă oblig sa anunț medicul curant în cazul în care trebuie să iau alte medicamente decât cele
prescrise de acesta (ex ketoconazol, eritromicină, ciclosporină, rifampicină, carbamazepină,
fenitoină, sunătoare etc).
Declar că sunt de acord cu întreruperea tratamentului în cazul apariției reacțiilor adverse care
nu pot fi gestionate prin reducerea dozelor sau lipsei de răspuns terapeutic.
Medicul specialist care a recomandat tratamentul:
………………………………………………………………………………………………
Unitatea sanitara unde se desfășoară monitorizarea:
tratamentului…………………………………………………………………………..…….
Va rugam sa răspundeți la întrebările de mai jos încercuind răspunsul potrivit:
1. Ați discutat cu medicul curant despre tratamentul pe care îl veți urma?
DA / NU
2. Ați înțeles care sunt beneficiile și riscurile acestui tratament?
DA / NU
3. Sunteți de acord sa urmați acest tratament?
DA / NU
4. Ați înțeles ca reacțiile adverse ale acestui tratament (cum ar fi greața, vărsăturile,
diareea, oboseala, anorexia, durerile abdominale, fenomenele trombocite) pot avea
consecințe asupra sănătății dumneavoastră și pot impune oprirea tratamentului?
DA / NU
Î
n cazul în care aveți reacții adverse puteți suna la medicul curant Dr
……………..………………….…
Tel……………………………. sau la Agenția Națională a Medicamentului și a Dispozitivelor
Medicale Adresa: Str. Aviator Sănătescu 48, Sector 1, București, Cod 011478, Tel: 021-
317.11.00; 021-317.11.01; 021-317.11.02; 021-317.11.04; 021-316.10.79; 0757.117.259. Fax:
021-316.34.97 Email: adr@anm.ro
Nume și prenume pacient …………..……………………….… Data
………………………
Semnatură pacient …………..……………………………………
Nume și prenume medic …..………..…………………………. Data
….……………………
Semnatură medic …..………..…………………………………….
Anexa nr. 2
Fișa Pacientului cu Pneumopatie Interstițială Difuză – Fenotip Fibrozant Progresiv






Cele mai noi stiri medicale:










