Protocol terapeutic
conform ordin MS/CNAS NR 564/499/2021
L01XC28 – DCI DURVALUMABUM
L01XC28 – DCI DURVALUMABUM
Citeste mai mult: https://www.formaremedicala.ro/l01xc28-dci-durvalumabum/
1. Definitia afectiunii: cancerul bronhopulmonar altul decât cel cu celule mici
I. Indicație terapeutica (face obiectul unui contract cost volum):
DURVALUMAB în monoterapie este indicat în tratamentul cancerului bronhopulmonar altul decât cel cu
celule mici (NSCLC) local avansat (stadiul 3), inoperabil, pentru pacienți adulți ale căror tumori
exprimă PD-L1 la ≥ 1% dintre celulele tumorale și a căror boală nu a progresat după radiochimioterapie cu compuși pe bază de platina
Această indicație se codifica la prescriere prin codul 111 (conform clasificării internaționale a maladiilor
revizia a 10-a, varianta 999 coduri de boala) si face obiectul unui contract cost-volum.
II. Criterii de includere:
1. vârstă peste 18 ani
2. status de performanta ECOG 0-2
3. pacienți diagnosticați cu cancer bronhopulmonar altul decât cel cu celule mici (NSCLC) local
avansat (stadiul 3), inoperabil, confirmat histopatologic, cu expresie PD-L1 la ≥ 1% (confirmata
printr-un test validat), a căror boală nu a progresat după radio-chimioterapie cu compuși pe bază
de platină
III. Criterii de excludere:
1. sarcina /alăptare
2. hipersensibilitate la substanța(ele) active(e) sau la oricare dintre excipienți
3. insuficienta renala severa
4. pacienți cu afecțiuni autoimune active*
5. istoric de imunodeficiență*
6. istoric de reacții adverse severe mediate imun*
7. afecțiuni medicale care necesită imunosupresie, cu excepția dozei fiziologice de corticoterapie
sistemica (maxim echivalent a 10mg prednison zilnic)*
8. tuberculoză activă, hepatită B sau C, infecție HIV, pacienți care au fost vaccinați cu vaccinuri vii
atenuate în ultimele 30 de zile înainte sau după inițierea tratamentului cu durvalumab. *
*Nota: pentru criteriile 4 – 8, durvalumab poate fi utilizat numai dacă, după evaluarea atentă a raportului beneficiu/risc,
pentru fiecare caz în parte, medicul curant va considera că beneficiile depășesc riscurile.
IV. Tratament
Evaluare pre-terapeutică (înainte de efectuarea chimioterapiei și radioterapiei)
– Confirmarea histopatologică a diagnosticului
– Evaluare clinică și imagistică pentru stadializare (stadiul 3 inoperabil) anterior chimioradioterapiei (planul de investigații va fi decis de către medicul curant)
– Evaluare biologica – adaptat la fiecare pacient în parte, in funcție de decizia medicului curant
Evaluare înainte de terapia de consolidare / întreținere cu durvalumab
In vederea inițierii tratamentului cu durvalumab, după radioterapie se va efectua o evaluare a extensiei
reale a afecțiunii la acel moment, conform practicii curente, pentru confirmarea statusului bolii, care
trebuie să fie fără semne /suspiciune de progresie (remisiune completă, remisiune parțială, boală
stabilizată).
– In cazul evaluărilor imagistice se va lua in considerare posibilitatea apariției unui proces
inflamator post-radioterapie la nivelul parenchimului pulmonar (pneumonita radică).
– In aceste cazuri, evaluările imagistice trebuie interpretate cu atenție, având in vedere posibilitatea
apariției unei false progresii de boala. In astfel de cazuri, se poate repeta evaluarea imagistica,
după începerea tratamentului cu durvalumab.
Doza
Doza recomandată de durvalumab este 10 mg/kg, administrată sub formă de perfuzie intravenoasă timp
de 60 de minute o dată la interval de 2 săptămâni sau 1.500mg la interval de 4 saptamani. Pacienții cu o
greutate corporală de cel mult 30 kg trebuie sa primească o doză calculată în funcție de
greutate,echivalentă cu IMFINZI 10 mg/kg la fiecare 2 săptămâni sau 20 mg/kg la fiecare 4 săptămâni
ca monoterapie,până la creșterea greutății peste 30 kg.
Durata tratamentului: până la progresia bolii sau toxicitate inacceptabilă, sau maximum 12 luni.
Modificarea dozei
• Nu se recomandă creșterea sau reducerea dozei. Întreruperea sau oprirea administrării poate fi
necesară în funcție de siguranța individuală și tolerabilitate (efecte secundare importante, severe).
• În funcție de gradul de severitate al reacției adverse si de tipul acesteia (mediată sau nonmediata imun), administrarea durvalumab trebuie amânată și trebuie administrată corticoterapia.
• După întrerupere, administrarea durvalumab poate fi reluată în 12 săptămâni dacă reacțiile adverse
s-au ameliorat până la un grad ≤1 și doza de corticosteroid a fost redusă la ≤10 mg prednison sau
echivalent pe zi.
• Durvalumabum trebuie întrerupt definitiv în cazul reacțiilor adverse mediate imun recurente de
grad 3 sau 4.
Grupe speciale de pacienți
Insuficiență renală
Nu se recomandă ajustarea dozei de durvalumabum la pacienții cu insuficiență renală ușoară sau
moderată. Nu se cunoaște efectul insuficienței renale severe (CrCl 15 – 29 ml/minut) asupra
farmacocineticii durvalumab.
Insuficiență hepatică
Datele despre pacienții cu insuficiență hepatică moderată și severă sunt limitate. Datorită implicării
minore a proceselor hepatice în clearance-ul durvalumab, nu se recomandă ajustarea dozei de
durvalumabum la pacienții cu insuficiență hepatică, deoarece nu este de așteptat nicio diferență de
expunere
V. Monitorizare
Răspunsul terapeutic va fi evaluat conform practicii clinice, în funcție de planul efectuat de către medicul
curant.
• Pentru a confirma etiologia reacțiile adverse mediate imun suspectate sau a exclude alte
cauze, trebuie efectuată o evaluare adecvată, comprehensivă și se recomandă consult
interdisciplinar.
• Evaluare biologica: in funcție de decizia medicului curant
VI. Efecte secundare. Managementul efectelor secundare mediate imun
Tratamentul cu durvalumab poate determina reacții adverse mediate imun, care necesita o evaluare
adecvata pentru confirmarea etiologiei imune sau excluderea cauzelor alternative, stabilirea severității
precum si a atitudinii terapeutice.
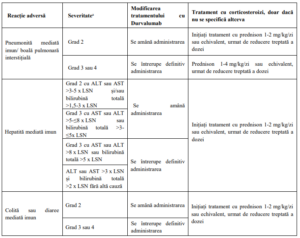
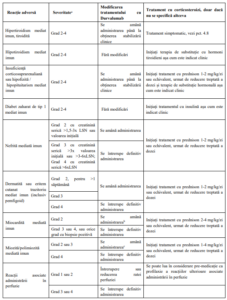
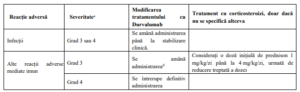
a Terminologia criteriilor pentru reacții adverse (CTCAE) versiunea 4.03. ALT: alanin aminotransferaza; AST: aspartat
aminotransferaza; LSN: limita superioară normală.
b Dacă nu apare o îmbunătățire în decurs de 3 până la 5 zile, în ciuda administrării corticosteroizilor, începeți prompt terapie
imunosupresoare suplimentară. La rezoluție (gradul 0), reducerea treptată a dozei de corticosteroid trebuie inițiată și
continuată cel puțin o lună, după care Durvalumab poate fi reluat pe baza unei evaluări clinice. c Opriți definitiv administrarea Durvalumab dacă reacția adversă nu se ameliorează la ≤ gradul 1 în decurs de 30 de zile sau
dacă există semne de insuficiență respiratorie.
d Pentru miastenia gravis, dacă există semne de slăbiciune musculară sau insuficiență respiratorie, administrarea Durvalumab
trebuie întreruptă definitiv.
VII. Criterii de întrerupere a tratamentului:
• progresia obiectivă a bolii (examene imagistice și clinice) in absenta beneficiului clinic
• toxicitate inacceptabilă,
• după un tratament de maximum 12 luni
• Cazurile cu progresie imagistica, fără deteriorare simptomatica, trebuie evaluate cu atenție,
având in vedere posibilitatea de apariție a falsei progresii de boala, prin instalarea unui
răspuns imunitar anti-tumoral puternic. In astfel de cazuri, nu se recomanda întreruperea
tratamentului. Se recomandă continuarea tratamentului pentru pacienții stabili clinic cu dovezi
inițiale de progresie a bolii până când progresia bolii este confirmată.
• Decizia medicului sau a pacientului
VIII. Prescriptori
Medicii din specialitatea oncologie medicală.
2. Definiția afecțiunii – Cancer bronhopulmonar cu celule mici
I. Indicația terapeutica (face obiectul unui contract cost volum):
Durvalumabum administrat in asociere cu etopozid și sare de platina (carboplatin sau cisplatin) este
indicat în tratamentul de primă linie pentru pacienții adulți cu cancer bronhopulmonar cu celule mici în
stadiul avansat (extensiv) – ES-SCLC: „extensive-stage small cell lung cancer”.
Aceasta indicație se codifica la prescriere prin codul 114 (conform clasificării internaționale a maladiilor
revizia a 10-a, varianta 999 coduri de boala).
II. Criterii de includere:
1. vârstă peste 18 ani
2. Indice al statusului de performanta ECOG 0-2
3. pacienți adulți, diagnosticați cu cancer bronhopulmonar cu celule mici în stadiul extensiv (ESSCLC), netratați anterior (necesita confirmare histologica a bolii si imagistica a stadiului avansat);
pot fi incluși in tratament pacienți care au fost diagnosticați cu metastaze cerebrale asimptomatice
sau care au fost tratate.
4. Pot beneficia de acest protocol pacienții tratați pentru stadiu incipient (limitat) de boala si care au
încheiat tratamentul adjuvant cu cel puțin 6 luni anterior diagnosticului recurentei bolii.
Nota: pot beneficia de durvalumabum pacienții cu aceasta indicație, care au primit anterior durvalumabum, din surse de
finanțare diferite de Programul National de Oncologie si nu au existat motive medicale întemeiate (lipsa beneficiului clinic sau
progresia bolii reconfirmata imagistic) de întrerupere a acestui tratament.
III. Criterii de excludere:
1. Sarcina /alăptare
2. Hipersensibilitate la substanța(ele) active(e) sau la oricare dintre excipienți
Contraindicații relative*:
1. pacienții cu istoric de radioterapie a toracelui
2. pacienți cu afecțiuni autoimune sau inflamatorii active sau documentate anterior, inclusiv sindrom
paraneoplazic (SNP)
3. pacienții cu istoric de imunodeficiențe primare active
4. istoric de reacții adverse severe mediate imun
5. tratament imunosupresor într-un interval de 14 zile înaintea primei doze de tratament, cu excepția
corticoterapiei in doza echivalenta 10 mg prednisone zilnic
6. tuberculoză activă sau hepatită B, C sau infecție HIV sau pacienți care au fost vaccinați cu
vaccinuri vii atenuate în ultimele 30 de zile, înainte sau după inițierea tratamentului cu
durvalumabum
*Nota : pentru situațiile 1-6, in absența datelor, durvalumab trebuie utilizat cu precauție la aceste grupe de pacienți, după
evaluarea atentă a raportului potențial beneficiu/risc în fiecare caz în parte.
IV. Tratament
Evaluare pre-terapeutică
– Confirmarea histopatologica a diagnosticului
– Evaluare clinică și imagistică pentru stadializare (cancer bronhopulmonar cu celule mici în stadiu
extins – ES-SCLC)
– Evaluare biologica: in funcție de decizia medicului curant
Doza si mod de administrare
Doza recomandată de durvalumabum este 1500 mg în combinație cu chimioterapia, la fiecare 3
săptămâni pentru 4 cicluri, după care durvalumabum 1500 mg la intervale de 4 săptămâni, în
monoterapie.
Pacienții cu greutate corporală ≤30 kg trebuie să primească o doză în funcție de greutate, echivalentă cu
durvalumab 20 mg/kg în combinație cu chimioterapia, pentru 4 cicluri, urmat de durvalumab 20 mg/kg la
intervale de 4 săptămâni, în monoterapie, până când greutatea corporală crește >30 kg.
Durvalumabum se administrează în perfuzie intravenoasă cu durata de 1 oră.
Durata tratamentului: până la progresia bolii sau toxicitate inacceptabilă
Tratamentul poate fi continuat la decizia medicului curant, daca progresia imagistica nu este însoțită de
deteriorare clinica si/sau pacientul continua sa aibă beneficiu clinic.
Modificarea dozei
– Nu se recomandă creșterea sau reducerea dozei. Întreruperea sau oprirea administrării poate fi
necesară în funcție de siguranța individuală și tolerabilitate.
– În funcție de gradul de severitate al reacției adverse si de tipul acesteia (mediata/ ne-mediata
imun) , administrarea durvalumab trebuie amânată și trebuie administrați corticosteroizi/ alt
tratament in funcție de tipul efectului secundar.
– După întrerupere, administrarea durvalumabum poate fi reluată în 12 săptămâni dacă reacțiile
adverse s-au ameliorat până la un grad ≤1 și doza de corticosteroid a fost redusă la ≤10 mg
prednison sau echivalent pe zi.
– Durvalumabum trebuie întrerupt definitiv în cazul reacțiilor adverse mediate imun recurente de
grad 3 sau 4 sau in cazul reacțiilor adverse ne-mediate imun de grad 4 (cu excepția anomaliilor de
laborator de gradul 4, care vor fi evaluate independent, in baza unui raport risc-beneficiu).
Grupe speciale de pacienți
Insuficiență renală
Nu se recomandă ajustarea dozei de durvalumabum la pacienții cu insuficiență renală ușoară sau
moderată. Nu se cunoaște efectul insuficienței renale severe (CrCl 15 – 29 ml/minut) asupra
farmacocineticii durvalumab.
Insuficiență hepatică
Datele despre pacienții cu insuficiență hepatică moderată și severă sunt limitate. Datorită implicării
minore a proceselor hepatice în clearance-ul durvalumab, nu se recomandă ajustarea dozei de
durvalumabum la pacienții cu insuficiență hepatică, deoarece nu este de așteptat nicio diferență de
expunere
V. Monitorizare
Răspunsul terapeutic va fi evaluat conform practicii clinice.
– Pentru a confirma etiologia reacțiile adverse mediate imun suspectate sau pentru a exclude
alte cauze, trebuie efectuată o evaluare adecvată și se recomandă consult interdisciplinar.
– Evaluare biologica: in funcție de decizia medicului curant
VI. Criterii de întrerupere a tratamentului:
– Progresia obiectivă a bolii (examene imagistice și clinice) in absenta beneficiului clinic;
tratamentul poate fi continuat la decizia medicului curant si cu acceptul pacientului, daca
progresia imagistica nu este însoțită de deteriorare clinica si/sau pacientul continua sa aibă
beneficiu clinic
– Toxicitate inacceptabilă
– Tratamentul cu durvalumabum trebuie oprit definitiv în cazul reacțiilor adverse mediate imun
recurente de grad 3 sau 4 sau al reacțiilor adverse ne-mediate imun, de gradul 4 (cu excepția
anomaliilor de laborator de gradul 4, care vor fi evaluate independent, in baza unui raport riscbeneficiu).
– Decizia medicului sau a pacientului
VII. Prescriptori
Medicii din specialitatea oncologie medicală.”
Cele mai noi stiri medicale: