Protocol terapeutic
conform ordin MS/CNAS NR 564/499/2021
L01BC59 – DCI COMBINAŢII (TRIFLURIDINUM + TIPIRACILUM)
L01BC59 – DCI COMBINAŢII (TRIFLURIDINUM + TIPIRACILUM)
Citeste mai mult: https://www.formaremedicala.ro/l01bc59-dci-combinatii-trifluridinumtipiracilum/
INDICAŢIE: neoplasm colorectal metastatic (CCR – cancer colorectal) tratat anterior.
DCI COMBINAŢII (TRIFLURIDINUM + TIPIRACILUM) este indicat pentru tratamentul pacienţilor adulţi cu
neoplasm colorectal metastatic (CCR – cancer colorectal), cărora li s-au administrat anterior tratamentele
disponibile sau care nu sunt consideraţi candidaţi pentru tratamentele disponibile. Acestea includ
chimioterapia pe bază de fluoropirimidină, oxaliplatină şi irinotecan, tratamentele anti-VEGF (Vascular
Endothelial Growth Factor) şi anti-EGFR (Epidermal Growth Factor Receptor).
I. CRITERII DE INCLUDERE:
• Diagnostic de neoplasm colorectal în stadiu evolutiv metastatic (mCCR)
• Tratament anterior cu următoarele produse/clase de medicamente sau contraindicaţie pentru
unele dintre acestea:
– chimioterapice antineoplazice*): oxaliplatin, irinotecan, fluoropirimidine;
– terapie ţintită molecular: inhibitori EGFR şi terapie antiangiogenică.
• Vârsta > 18 ani
• Indice al statusului de performanţă ECOG 0, 1 sau 2
_____________
*) Vor fi luate în calcul inclusiv terapiile utilizate pentru indicaţia de adjuvanţă, dacă progresia bolii, după
tratamentul respectiv, a apărut în mai puţin de 12 luni de finalizarea acestuia.
II. CRITERII DE EXCLUDERE:
• Insuficienţa renală severă
• Insuficienţa hepatică moderată sau severă
• Hipersensibilitate la substanţele active sau la oricare dintre excipienţi.
III. TRATAMENT ŞI MOD DE ADMINISTRARE
Doze
Doza recomandată de DCI COMBINAŢII (TRIFLURIDINUM + TIPIRACILUM ) pentru adulţi este de 35
mg/m2
/doză, administrată oral de două ori pe zi, în zilele 1 – 5 şi în zilele 8 – 12 ale fiecărui ciclu de 28 de
zile, atât timp cât există un beneficiu sau până la apariţia unei toxicităţi inacceptabile.
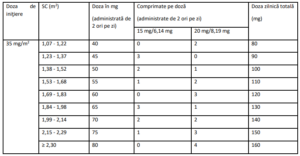
Doza se calculează în funcţie de suprafaţa corporală (SC) (vezi Tabelul 1). Doza nu trebuie să depăşească
80 mg/administrare (maxim 160 mg/zi).
Dacă se omite o doză, pacientul nu trebuie să compenseze doza uitată.
Tabelul 1 – Calculul dozei în funcţie de suprafaţa corporală (SC)
Mod de administrare
DCI COMBINAŢII (TRIFLURIDINUM + TIPIRACILUM) se administrează pe cale orală. Comprimatele trebuie
înghiţite cu un pahar cu apă, în decurs de 1 oră de la încheierea mesei de dimineaţă şi de seară.
Ajustări ale dozelor recomandate
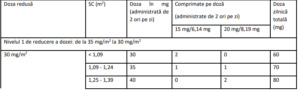
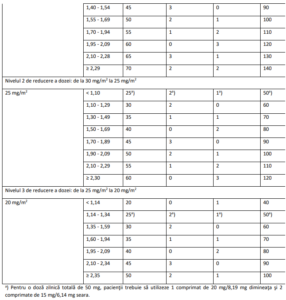
Este posibil să fie necesară ajustarea dozelor pe baza siguranţei şi tolerabilităţii individuale. Sunt permise
maximum 3 scăderi ale dozei până la doza minimă de 20 mg/m2 de două ori pe zi. După scădere,
creşterea dozei nu mai este permisă. În cazul apariţiei toxicităţii hematologice şi/sau non-hematologice,
pacienţii trebuie să respecte criteriile de întrerupere, reluare şi scădere a dozelor prezentate în Tabelele
2, 3 şi 4.
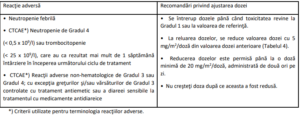
Tabelul 2: Criterii de întrerupere şi reluare a dozelor în caz de toxicitate hematologică asociată cu
mielosupresie

Tabelul 3 – Recomandări privind ajustarea dozei în caz de apariţie a reacţiilor adverse hematologice şi nonhematologice
Tabelul 4 – Reducerea dozei în funcţie de suprafaţa corporală (SC)
Grupe speciale de pacienţi
Insuficienţă renală
Insuficienţă renală uşoară (CrCl între 60 şi 89 ml/min) sau insuficienţă renală moderată (CrCl între 30 şi
59 ml/min) – nu se recomandă ajustarea dozei de iniţiere la pacienţii cu insuficienţă renală uşoară sau
moderată.
Insuficienţă renală severă (CrCl sub 30 ml/min) sau boală renală în stadiu terminal
Nu se recomandă administrarea la pacienţii cu insuficienţă renală severă sau boală renală în stadiu
terminal deoarece nu există date disponibile pentru aceşti pacienţi.
Insuficienţă hepatică
Insuficienţă hepatică uşoară
Nu se recomandă ajustarea dozei de iniţiere la pacienţii cu insuficienţă hepatică uşoară.
Insuficienţă hepatică moderată sau severă
Nu se recomandă administrarea la pacienţii cu insuficienţă hepatică iniţială moderată sau severă
(Grupele C şi D conform criteriilor National Cancer Institute [NCI] exprimate prin bilirubină totală > 1,5 x
LSN), deoarece o incidenţă mai mare a hiperbilirubinemiei de Gradul 3 sau 4 este observată la pacienţii
cu insuficienţă hepatică iniţială moderată, cu toate că acest lucru se bazează pe date foarte limitate.
Vârstnici
Nu este necesară ajustarea dozei la pacienţii cu vârsta ≥ 65 ani. Datele privind eficacitatea şi siguranţa la
pacienţi cu vârsta peste 75 ani sunt limitate.
Femei aflate la vârsta fertilă
Trebuie evitată sarcina pe parcursul tratamentului şi până la 6 luni după tratament. De aceea, femeile
aflate la vârsta fertilă trebuie să utilizeze măsuri contraceptive extrem de eficace în timp ce utilizează DCI
COMBINAŢII (TRIFLURIDINUM + TIPIRACILUM )şi până la 6 luni după tratament. Bărbaţii care au
partenere aflate la vârstă fertilă trebuie să utilizeze măsuri contraceptive eficace în timpul tratamentului
şi până la 6 luni tratament.
Sarcina
Datele provenite din utilizarea DCI COMBINAŢII (TRIFLURIDINUM + TIPIRACILUM) la femeile gravide sunt
inexistente. DCI COMBINAŢII (TRIFLURIDINUM + TIPIRACILUM) nu trebuie utilizat în timpul sarcinii, cu
excepţia cazului în care starea clinică a femeii necesită tratament cu acest medicament.
Alăptarea
Nu se cunoaşte dacă DCI COMBINAŢII (TRIFLURIDINUM + TIPIRACILUM) sau metaboliţii săi se excretă în
laptele uman. Alăptarea trebuie întreruptă în timpul tratamentului.
Fertilitatea
Nu sunt disponibile date privind efectul DCI COMBINAŢII (TRIFLURIDINUM + TIPIRACILUM) asupra
fertilităţii la om. Rezultatele studiilor la animale nu au indicat un efect al medicamentului asupra
fertilităţii feminine sau masculine.
IV. MONITORIZAREA TRATAMENTULUI
Statusul hematologic complet trebuie obţinut anterior iniţierii terapiei, precum şi un nivel minim al
acestuia înaintea fiecărui ciclu de tratament, deoarece este necesar pentru monitorizarea toxicităţii.
Tratamentul nu trebuie început dacă numărul absolut al neutrofilelor (NAN) este < 1.5 ×109
/l, dacă
valoarea trombocitelor este < 75×109
/, sau dacă pacientul are toxicitate non-hematologică de Gradul 3
sau 4 netratată, relevantă clinic, dobândită în urma terapiilor anterioare.
În urma tratamentului cu DCI COMBINAŢII (TRIFLURIDINUM + TIPIRACILUM) au fost raportate infecţii
grave. Deoarece majoritatea au fost raportate în contextul supresiei măduvei osoase, starea pacientului
trebuie monitorizată atent şi, dacă este necesar din punct de vedere clinic, trebuie administrate
tratamente adecvate, cum sunt medicamentele antibiotice şi G-CSF (granulocyte-colony stimulating
factor).
Toxicitate gastro-intestinală
DCI COMBINAŢII (TRIFLURIDINUM + TIPIRACILUM) a produs o creştere a incidenţei toxicităţii gastrointestinale, incluzând greaţă, vărsături şi diaree.
Pacienţii care prezintă greaţă, vărsături, diaree şi alte tipuri de toxicitate gastro-intestinală trebuie
monitorizaţi atent şi, dacă este necesar din punct de vedere clinic, trebuie administrate tratamente
antiemetice, antidiareice, precum şi alte măsuri cum este tratamentul de substituţie hidroelectrolitic.
Dacă este necesar, trebuie aplicată ajustarea dozelor (amânarea şi/sau reducerea).
Insuficienţă renală
Nu se recomandă utilizarea la pacienţii cu insuficienţă renală severă sau boală renală în stadiu terminal
(clearance-ul creatininei [CrCl] < 30 ml/min sau, respectiv, necesitatea dializei), deoarece DCI
COMBINAŢII (TRIFLURIDINUM + TIPIRACILUM) nu a fost studiat la această categorie de pacienţi.
Pacienţii cu insuficienţă renală moderată (CrCl = 30 – 59 ml/min) au avut o incidenţă mai mare (definită
ca o diferenţă de cel puţin 5%) a evenimentelor adverse (EA) de Gradul 3 sau mai mare, a EA grave şi a
întârzierii administrării şi reducerii dozelor, comparativ cu pacienţii cu funcţie renală normală (CrCl ≥ 90
ml/min) sau cu insuficienţă renală uşoară (CrCl = 60 – 89 ml/min). În plus, la pacienţii cu insuficienţă
renală moderată a fost observată o expunere mai mare la trifluridină şi tipiracil, comparativ cu pacienţii
cu funcţie renală normală sau cu pacienţii cu insuficienţă renală uşoară. Pacienţii cu insuficienţă renală
moderată trebuie monitorizaţi frecvent din punct de vedere al toxicităţii hematologice.
Insuficienţă hepatică
Nu se recomandă utilizarea la pacienţii cu insuficienţă hepatică iniţială moderată sau severă (Grupele C şi
D conform criteriilor National Cancer Institute [NCI] exprimate prin bilirubină totală > 1,5 LSN) deoarece
o incidenţă mai mare a hiperbilirubinemiei de Gradul 3 sau 4 este observată la pacienţii cu insuficienţă
hepatică iniţială moderată, cu toate că acest lucru se bazează pe date foarte limitate.
Proteinurie – Se recomandă monitorizarea proteinuriei cu ajutorul bandeletelor reactive, înaintea şi în
timpul tratamentului.
Intoleranţa la lactoză
DCI COMBINAŢII (TRIFLURIDINUM+TIPIRACILUM) conţine lactoză. Pacienţii cu probleme ereditare rare
de intoleranţă la galactoză, deficienţă de Lapp-lactază sau malabsorbţie de glucoză-galactoză nu trebuie
să utilizeze acest medicament.
V. PRESCRIPTORI: medici în specialitatea Oncologie Medicală.
Cele mai noi stiri medicale:










