Protocol terapeutic
conform ordin MS/CNAS NR 564/499/2021
J05AP – HEPATITĂ CRONICĂ ŞI CIROZĂ HEPATICĂ CU VHC – MEDICAMENTE CU ACŢIUNE ANTIVIRALĂ DIRECTĂ (INTERFERON-FREE)
J05AP – HEPATITĂ CRONICĂ ŞI CIROZĂ HEPATICĂ CU VHC – MEDICAMENTE CU ACŢIUNE ANTIVIRALĂ DIRECTĂ (INTERFERON-FREE)
Citeste mai mult: https://www.formaremedicala.ro/j05ap-dci-hepatita-cronica-si-ciroza-hepatica-compensata-cu-vhc-cu-medicamente-cu-actiune-antivirala-directa-interferon-free/
DCI: Sofosbuvirum+ Ledipasvirum (Harvoni)
DCI: Ombitasvirum + Paritaprevirum+ Ritonavirum (Viekirax) + Dasabuvirum (Exviera);
DCI: SOFOSBUVIR + VELPATASVIR (Epclusa)
DCI: GLECAPREVIR + PIBRENTASVIR (Maviret)
I. PACIENŢII ADULŢI CU HEPATITĂ CRONICĂ HCV CU FIBROZĂ ABSENTĂ
PÂNĂ LA SEVERĂ (FO – F3)
1. Criterii de includere
a) Pacienți naivi (fără tratamente antivirale anterioare cu peg-interferon în asociere cu
Ribavirina) cu hepatită cronică cu fibroză F0, F1, F2, F3
b) Pacienți care au fost în tratament antiviral anterior (experimentaţi) cu peg-interferon +
Ribavirină – cu fibroză F0, F1 și F2, F3
c) Pacienți cu coinfectie VHC-HIV (tratamentul va fi recomandat şi monitorizat în centrele
regionale HIV/SIDA de către medici specialiști boli infecţioase).Pe perioada pandemiei de
COVID-19 având în vedere faptul că, în anumite situaţii, accesul acestor pacienți în centrele
regionale HIV este limitat, tratamentul poate fi iniţiat și continuat şi de medicul
gastroenterolog, la recomandarea medicului infecționist, iar pacientul este monitorizat în
colaborare cu acesta.
d) Pacienți cu coinfecţie VHB-VHC – Pacienții cu coinfecţie VHB confirmată la iniţierea
tratamentului cu medicamente cu acţiune antivirală directă, – dacă pacientul îndeplineşte
criteriile de terapie VHB (conform protocol CNAS/MS), se începe concomitent şi
tratamentul cu analogi nucleotidici/nucleozidici pentru VHB utilizându-se aceleaşi criterii
de monitorizare, iar dacă are AgHBs pozitiv dar nu intruneşte criteriile standard de tratament
VHB, trebuie tratat cu analogi nucleozidici/nucleotidici în dozele standard pentru VHB pe
parcursul terapiei anti VHC plus încă 12 săptămâni după finalizarea terapiei VHC
e) Pacienţii cu hepatocarcinom şi infecţie cronică VHC fără ciroză hepatică eligibili pentru
tratament potenţial curativ (rezecţie sau ablaţie) vor fi trataţi cu medicamente antivirale
directe după finalizarea tratamentului pentru hepatocarcinom. Pacienţii cu hepatocarcinom şi
infecţie cronică VHC listaţi pentru transplant hepatic pot fi trataţi antiviral înainte sau după
transplantul hepatic cu medicamente pangenotipice sau medicamente genotip specifice,
conform RCP produs.
f) Pacienți cu afecțiuni maligne extrahepatice pot fi trataţi, după evaluare imagistică şi acordul
specialistului oncolog/hematolog.
2. Evaluarea pre-terapeutică
a) Evaluarea fibrozei hepatice (în sistemul Metavir) se va efectua prin
– Testul de evaluare a fibrozei APRI (AST to Platelet Ratio Index)*sau
– Elastografie hepatică (Fibroscan sau alte determinări) sau
– Fibromax sau
– PBH
* (În cazul în care APRI este peste 0,50 se recomandă evaluarea gradului de fibroză şi prin una din celelalte metode)
2
Vor fi luate în considerare și determinările anterioare sau curente care arată absenţa fibrozei (F0)
sau existența fibrozei F1 sau F2 sau F3 ( PBH sau Fibroscan sau alte metode de elastografie
hepatică sau Fibromax) dar nu mai vechi de 2 ani.
Gradul de fibroză hepatică se determină doar dacă medicul curant apreciază că este necesar pentru
includerea corectă a pacientului în tratament şi alegerea schemei terapeutice şi a duratei optime a
acesteia.
b) Determinarea cantitativă a ARN-VHC (ARN VHC peste limita de detecție ≥15UI/ml).
Tratamentul este indicat indiferent de valoarea ARN VHC . (se ia in considerare si o determinare
anterioara (maxim 12 luni)
c) anticorpi anti HCV pozitivi. Poate fi luată în considerare şi o determinare anterioară.
d) Transaminazele serice (ALT, AST)
e) Hemograma
f) Creatinina serică (la pacienţii cu insuficienţă renală cronică este necesară şi rata de filtrare
glomerulară);
g) Evaluarea şi înregistrarea corectă şi completă a medicamentelor utilizate de pacient în vederea
evitării contraindicaţiilor sau interacţiunilor medicamentoase (vezi Rezumatul Caracteristicilor
Produselor)
h) genotiparea (optionala) – poate fi efectuată la recomandarea medicului prescriptor, în funcţie de
încadrarea pacientului într-o grupă de risc de a prezenta alt genotip decât 1B şi în funcţie de
schema terapeutică ce urmează a fi recomandată
i) ecografie abdominală
3. Criterii de excludere/contraindicaţii
a) Comorbidităţile extra-hepatice severe care implică o durată de viaţă limitată
b) Contraindicaţiile medicamentoase specifice pentru optiunea terapeutică aleasă: vezi Rezumatul
Caracteristicilor Produselor Harvoni, Viekirax+Exviera, Epclusa, Maviret
4. Tratament cu una dintre următoarele opțiuni-posologie:
1. Harvoni: 1 cp.pe zi cu sau fără alimente
sau
2. Viekirax: 2 cp.dimineaţa+ Exviera-1 cp. dimineaţa şi 1 cp.seara, cu alimente
sau
3. Epclusa: 1 cp.pe zi cu sau fără alimente
sau
2. Maviret: 3 cp.odată pe zi cu alimente
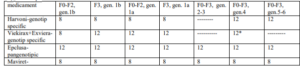
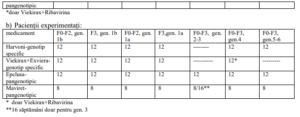
5. Durata tratamentului (săptămâni):
a) Pacienții naivi.
6. Monitorizarea tratamentului
În timpul tratamentului
Pacienţii cu infecţie ocultă VHB (Ag HBs negativ, Ac anti HBc pozitiv, Ac anti HBs negativ) vor fi
monitorizaţi lunar pe parcursul tratamentului cu medicamente cu acţiune antivirală directă: ALT,
AST (lunar).
Dacă pe parcursul monitorizării se constată creșterea transaminazelor, (sau lipsa de normalizare
daca anterior erau crescute) se va repeta Ag HBs si DNA VHB. Dacă una dintre ele este pozitivă
(indiferent de nivel) se începe tratamentul pentru VHB conform recomandărilor anterioare.
La terminarea tratamentului: Transaminazele serice, Hemograma
La 12 săptămâni de la terminarea tratamentului
Viremia cantitativă (RVS-12) : ARN VHC
7. Criterii de evaluare a rezultatului terapiei
a) Răspuns virusologic susţinut (RVS-12):
– ARN-VHC nedetectabil la 12 săptămâni de la terminarea tratamentului.
b) Eșec terapeutic:
– ARN-VHC detectabil indiferent de nivelul de detecţie la 12 săptămâni de la terminarea
tratamentului.
8. Prescriptori
Medicii în specialitatea gastroenterologie şi medicii în specialitatea boli infecţioase, aflaţi în relaţii
contractuale cu casele de asigurări de sănătate: Arad, Argeş, Bucureşti, Bacău, Bihor, Braşov, Cluj,
Constanţa, Dolj, Galaţi, Iaşi, Mureş, Sibiu, Timiş, Suceava, Vâlcea şi CAS AOPSNAJ
II. PACIENŢII ADULŢI CU HEPATITĂ CRONICĂ HCV CU CIROZĂ COMPENSATĂ –
scor Child – Pugh A
1. Criterii de includere
4
a) Pacienţi naivi (fără tratamente antivirale anterioare pe bază de peg-interferon) cu fibroză F4
( ciroză compensată Child – Pugh A).
b) Pacienţi experimentaţi (tratamente antivirale anterioare cu peg-interferon +Ribavirină) cu F4
(ciroză compensată Child – Pugh A).
c) Pacienții cu coinfecţie VHC-HIV (tratamentul va fi recomandat şi monitorizat în centrele
regionale HIV/SIDA de către medici specialişti boli infecţioase). Pe perioada pandemiei de
COVID-19 având în vedere faptul că, în anumite situaţii, accesul acestor pacienți în centrele
regionale HIV este limitat, tratamentul poate fi iniţiat și continuat şi de medicul
gastroenterolog, la recomandarea medicului infecționist, iar pacientul este monitorizat în
colaborare cu acesta.
d) Pacienții cu coinfecţie VHC-VHB
Pacienții cu coinfecţie VHB confirmată la iniţierea tratamentului cu medicamente cu acţiune
antivirală directă, – dacă pacientul îndeplineşte criteriile de terapie VHB (conform protocol
CNAS/MS), se începe concomitent şi tratamentul cu analogi nucleotidici/nucleozidici pentru
VHB utilizându-se aceleaşi criterii de monitorizare, iar dacă are AgHBs pozitiv dar nu
întruneşte criteriile standard de tratament VHB, trebuie tratat cu analogi
nucleozidici/nucleotidici în dozele standard pentru VHB pe parcursul terapiei anti VHC plus
încă 12 săptămâni după finalizarea terapiei VHC.
e) Pacienţii cu hepatocarcinom şi infecţie cronică VHC cu ciroză hepatică compensată eligibili
pentru tratament potenţial curativ (rezecţie sau ablaţie) vor fi trataţi cu medicamente
antivirale directe după finalizarea tratamentului pentru hepatocarcinom. Pacienţii cu
hepatocarcinom şi infecţie cronică VHC listaţi pentru transplant hepatic pot fi trataţi
antiviral înainte sau după transplantul hepatic cu medicamente pangenotipice sau
medicamente genotip specifice, conform RCP produs.
f) Pacienții cu afecțiuni maligne extrahepatice pot fi trataţi, după evaluare imagistică şi acordul
specialistului oncolog/hematolog.
2. Evaluarea pre-terapeutică
a) Evaluarea fibrozei hepatice (în sistemul Metavir) se va efectua prin:
– Testul de evaluare a fibrozei APRI (AST to Platelet Ratio Index)* sau
– Elastografie hepatică (Fibroscan sau alte determinări) sau
– Fibromax sau
– PBH
* (În cazul în care APRI este peste 0,50 se recomandă evaluarea gradului de fibroză şi prin una din celelalte metode)
Vor fi luate în considerare și determinările anterioare sau curente care arată existența fibrozei F4
(PBH sau Fibroscan sau alte metode de elastografie hepatică sau Fibromax) dar nu mai vechi de 2
ani.
Atunci când ciroza este evidentă (clinic,imagistic) sau sunt prezente semnele hipertensiunii portale
(varice esofagiene) – evaluarea gradului fibrozei nu mai este necesară.
b) ARN-VHC (peste limita de detecţie ≥15UI/ml) – indiferent de valoare. (se ia in considerare si
o determinare anterioara (maxim 12 luni)
c) anticorpi anti HCV pozitivi. Poate fi luată în considerare şi o determinare anterioară.
d) Transaminazele serice (ALT, AST) – indiferent de valoare
e) Hemograma
f) Albumina serică
g) Bilirubina
h) TP (INR)
i) Alfa-fetoproteina; în cazul în care nivelul seric al AFP depăşeşte 50 ng/ml, se recomandă
examen CT sau IRM abdomen cu substanţă de contrast i.v. pentru excluderea
hepatocarcinomului
5
j) Creatinina serică (la pacienţii cu insuficienţă renală cronică este necesară şi rata de filtrare
glomerulară);
k) Ecografia abdominală (suspiciunea de HCC impune CT şi/sau RMN cu substanţă de contrast)
l) Endoscopia digestivă superioară (varice esofagiene, risc de sângerare, gastropatie portalhipertensivă)
m) Bolile asociate (pulmonare, cardiace, renale etc) impun consultarea și evaluarea
contraindicațiilor din punct de vedere al specialității respective pentru introducerea
tratamentului antiviral.
n) Evaluarea şi înregistrarea corectă şi completă a medicamentelor utilizate de pacient în vederea
evitării contraindicațiilor sau interacțiunilor medicamentoase (vezi Rezumatul Caracteristicilor
Produselor sau http//www.hepdruginteractions.org).
o) genotiparea (optionala) – poate fi efectuată la recomandarea medicului prescriptor, în funcţie de
încadrarea pacientului într-o grupa de risc de a prezenta alt genotip decât 1 B şi în funcţie de
schema terapeutica ce urmează a fi recomandată.
3. Criterii de excludere/contraindicaţii
a) Cirozele decompensate (ascită, icter, hemoragie digestivă, encefalopatie hepatică, peritonită
bacteriană spontană, sindrom hepato-renal) actual sau în antecedente, scorul Child-Pugh> 6
puncte
b) Comorbidităţile extra-hepatice care implică o durată de viaţă limitată
c) Contraindicaţiile medicamentoase specifice pentru opțiunea terapeutică aleasă: vezi Rezumatul
Caracteristicilor Produselor Harvoni, Viekirax+Exviera, Epclusa, Maviret
4. Tratament cu una dintre următoarele opțiuni-posologie:
1 .Harvoni: 1cp pe zi cu sau fără alimente
sau
2. Viekirax : 2 cp dimineata+ Exviera -1 cp dimineaţa şi 1 cp seara, cu alimente
sau
3. Epclusa: 1cp zi cu sau fără alimente
sau
4. Maviret: 3 cp odată pe zi cu alimente
5. Durata tratamentului (săptămâni):
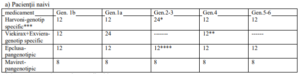
* doar pentru gen. 3 în asociere cu Ribavirina
** doar Viekirax+Ribavirina
*** Asocierea Ribavirinei la tratamentul cu Harvoni 12 săptămâni va fi decisă de medicul curant în funcţie de starea
clinică a pacientului şi conform ghidurilor internaţionale de tratament a infecţiei cu VHC
**** Se poate lua in considerare adaugarea Ribavirinei la pacientii cu genotip 3. La utilizarea în asociere cu
ribavirină, trebuie consultat Rezumatul caracteristicilor produsului pentru medicamentul prescris.

* doar pentru gen. 3 în asociere cu Ribavirina
** doar Viekirax+Ribavirina
*** Asocierea Ribavirinei la tratamentul cu Harvoni 12 săptămâni va fi decisă de medicul curant în funcţie de starea
clinică a pacientului şi conform ghidurilor internaţionale de tratament a infecţiei cu VHC
****16 săptămâni doar pentru gen. 3
***** Se poate lua in considerare adaugarea Ribavirinei la pacientii cu genotip 3. La utilizarea în asociere cu
ribavirină, trebuie consultat Rezumatul caracteristicilor produsului pentru medicamentul prescris
6. Monitorizarea tratamentului
În timpul tratamentului
Pacienţii cu infecţie ocultă VHB (Ag HBs negativ, Ac anti HBc pozitiv, Ac anti HBs negativ) vor fi
monitorizaţi lunar pe parcursul tratamentului cu medicamente cu acţiune antivirală directă: ALT,
AST lunar. Dacă pe parcursul monitorizării se constată creșterea transaminazelor (sau lipsa de
normalizare daca anterior erau crescute), se va repeta Ag HBs si DNA VHB. Dacă una dintre ele
este pozitivă (indiferent de nivel) se începe tratamentul pentru VHB conform recomandărilor
anterioare.
La sfârşitul tratamentului (săptămâna 12) evaluare biochimică: ALT, AST şi analizele pe baza
căruia se calculează scorul Child (F4).
La 12 săptămâni de la terminarea tratamentului :
Viremia cantitativă (RVS-12) : ARN VHC
Notă : Pacienţii cu ciroză compensată (F4) vor fi evaluați ulterior la fiecare 6 luni biochimic şi
ecografic, conform recomandărilor ghidurilor de specialitate (riscul de decompensare, de HDS și
HCC deși mai redus, se menține)
7. Criterii de evaluare a rezultatului tratamentului
a) Răspuns viral susţinut (RVS-12):
– ARN-VHC nedetectabil la 12 săptămâni de la terminarea tratamentului.
b) Eșec terapeutic:
– ARN-VHC detectabil, indiferent de nivelul de detecţie, la 12 săptămâni de la terminarea
tratamentului.
8. Prescriptori
Medicii în specialitatea gastroenterologie şi medicii în specialitatea boli infecţioase, aflaţi în relatii
contractuale cu casele de asigurari de sănătate: Arad, Argeş, Bucureşti, Bacău, Bihor, Braşov, Cluj,
Constanţa, Dolj, Galaţi, Iaşi, Mureş, Sibiu, Timiş, Suceava, Vâlcea şi CAS AOPSNAJ
7
III. CATEGORII SPECIALE DE PACIENŢI ADULŢI INFECTAŢI CU VIRUSUL
HEPATITIC C
A.Pacienţi cu ciroză hepatică decompensată (clasa Child B sau C) şi pacienţi cu ciroză hepatică
compensată cu episoade de decompensare în antecedente
a) medicamente pangenotipice
– Epclusa 1cp/zi,+RIBAVIRINA* 1000 mg/zi pentru greutate <75 kg, respectiv 1200 mg/zi
pentru greutate ≥ 75 kg, 12 săptămâni
b) medicamente genotip specifice
– Harvoni 1cp/zi,+RIBAVIRINA* 1000 mg/zi pentru greutate <75 kg, respectiv 1200 mg/zi
pentru greutate ≥ 75 kg, 12 săptămâni
– Harvoni 1cp/zi, 24 săptămâni pentru pacienţii cu contraindicaţie la Ribavirina sau cu
intoleranţă la Ribavirina
*La pacientii cu scor Child C se administrează initial RIBAVIRINĂ 600 mg/zi şi se creşte progresiv în acord cu
toleranţa pacientului, conform RCP produs.
Notă. Evaluarea pre-terapeutica, monitorizarea tratamentului, criteriile de evaluare a rezultatului
medical şi medicii prescriptori sunt conform pct. 2, 6, 7 si 8 de la cap II.
B.Pacienţi cu infecţie cronică VHC şi afectare renală severă (eGFR<30 ml/min/1.73 m2) şi cei
hemodializaţi
B.1. Pacienţi cu hepatită cronică VHC fibroză F0-F3 sau ciroză compensată şi afectare renală
severă (eGFR<30 ml/min/1.73 m2) şi cei hemodializaţi
a) medicamente pangenotipice
– Maviret fara ajustarea dozei si posologiei prevazuta la cap I pct. 4 si 5 si cap II pct. 4 si 5
– Epclusa fara ajustarea dozei si posologiei prevazuta la cap I pct. 4 si 5 si cap II pct. 4 si 5,
doar în situaţia în care nu sunt disponibile alte opţiuni de tratament relevante
b)medicamente genotip specifice
– Viekirax+Exviera fara ajustarea dozei si posologiei prevazuta la cap I pct. 4 si 5 si cap II
pct. 4 si 5
– Harvoni poate fi utilizata la aceasta categorie de pacienti fara ajustarea dozei si posologiei
prevazuta la cap I pct. 4 si 5 si cap II pct. 4 si 5, doar în situaţia în care nu sunt disponibile
alte opţiuni de tratament relevante
B.2. Pacienţi cu ciroză hepatică decompensată (clasa Child Pugh B sau C) şi afectare renală
severă (eGFR<30 ml/min/1.73 m2) şi cei hemodializaţi
Medicamente pangenotipice
– Epclusa fara ajustarea dozei si posologiei prevazuta la cap I pct. 4 si 5 si cap II pct. 4 si 5,
Nota. La pacientii cu afectare renala severa (inclusiv hemodializa) care necesita administrare de
Ribavirina, se va consulta RCP-ul pentru Ribavirina pentru informatiile privind ajustarea dozei.
Evaluarea pre-terapeutică, monitorizarea tratamentului, criteriile de evaluare a rezultatului medical
şi medicii prescriptori sunt conform pct. 2, 6, 7 şi 8 de la cap I sau cap II, după caz, cu precizarea
faptului că, iniţierea şi monitorizarea tratamentului include efectuarea lunară a clearance-ului
8
la creatinină, indiferent de regimul terapeutic, şi după caz, medicul prescriptor poate recurge la
consultul nefrologic dacă situaţia o impune, având în vedere contraindicaţiile şi interacţiunile
medicamentoase potenţiale.
C. Pacienti cu transplant hepatic
a) medicamente pangenotipice
– Epclusa:
• 1cp/zi, 12 saptamani (F0-F3+ ciroză compensată – scor Child – Pugh A). Se poate lua
in considerare adaugarea Ribavirinei la pacientii cu genotip 3.
• 1cp/zi,+RIBAVIRINA (se va consulta RCP-ul pentru Ribavirina pentru informatiile
privind doza), 12 săptămâni (ciroză hepatică decompensată -clasa Child B sau C)
– Maviret – 3 cp/zi, 12 saptamani (F0-F3+ ciroză compensată – scor Child – Pugh A).
Trebuie luata in considerare o durata a tratamentului de 16 saptamani la pacientii
experimentati, cu genotip 3
b) medicamente genotip specifice
– Harvoni:
• 1cp/zi, 12 săptămâni (F0-F3+ ciroză compensată – scor Child – Pugh A) ±.
RIBAVIRINA. Asocierea Ribavirinei la tratamentul cu Harvoni 12 săptămâni va fi
decisă de medicul curant în funcţie de starea clinică a pacientului şi conform ghidurilor
internaţionale de tratament a infecţiei cu VHC
• 1 cp/zi+RIBAVIRINA (se va consulta RCP-ul pentru Ribavirina pentru informatiile
privind doza), 12 săptămâni ( ciroză hepatică decompensată -clasa Child B sau C)
• 1cp/zi, 24 săptămâni pentru pacienţii cu contraindicaţie la Ribavirina sau cu intoleranţă
la Ribavirina
– Viekirax +Exviera – 2 cp/zi V+ 2 cp/zi E + RIBAVIRINA (se va consulta RCP-ul pentru
Ribavirina pentru informatiile privind doza), 24 săptămâni (F0-F3+ ciroză compensată –
scor Child – Pugh A, genotip 1).
– Viekirax – 2 cp/zi + RIBAVIRINA (se va consulta RCP-ul pentru Ribavirina pentru
informatiile privind doza), 24 săptămâni (F0-F3+ ciroză compensată – scor Child – Pugh
A, genotip 4).
Notă. Evaluarea pre-terapeutică, monitorizarea tratamentului, criteriile de evaluare a rezultatului
medical şi medicii prescriptori sunt conform pct. 2, 6, 7 şi 8 de la cap I sau cap II, după caz cu
precizarea faptului că, monitorizarea pacientului se va face de medicul prescriptor împreună cu
medicul curant din centrul care se ocupă de monitorizarea post-transplant.
D. Pacienti cu transplant renal
Medicamente pangenotipice
-Maviret 3 cp/zi, 12 saptamani (F0-F3+ ciroză compensată – scor Child – Pugh A). Trebuie
luata in considerare o durata a tratamentului de 16 saptamani la pacientii experimentati cu
genotip 3.
9
Notă. Evaluarea pre-terapeutică, monitorizarea tratamentului, criteriile de evaluare a rezultatului
medical şi medicii prescriptori sunt conform pct. 2, 6, 7 şi 8 de la cap I sau cap II, după caz cu
precizarea faptului că, monitorizarea pacientului se va face de medicul prescriptor împreună cu
medicul curant din centrul care se ocupă de monitorizarea post-transplant.
IV. Categorii de pacienţi adolescenţi cu vârsta cuprinsă între 12 şi < 18 ani cu infectie cu VHC
eligibili
1. Pacienţii cu fibroză F0-F3
a. naivi la interferon + ribavirina, genotip 1B,
Harvoni 1 cp/zi, 8 săptămâni
Maviret 3 cp/zi 8 săptămâni
b. naivi la interferon + ribavirina, oricare alt genotip în afara de genotipul 1B
Harvoni 1 cp/zi 12 săptămâni
Maviret 3 cp/zi 8 săptămâni
c. experimentaţi la interferon + ribavirina oricare genotip în afara de genotipul 3
Harvoni 1 cp/zi 12 săptămâni
Maviret 3 cp/zi 8 săptămâni
d. experimentaţi la interferon + ribavirina genotip 3
Harvoni 1 cp/zi, 12 săptămâni
Maviret 3 cp/zi 16 săptămâni
2. Pacienţii cu ciroza hepatică compensată scor Child A
a. naivi la interferon + ribavirina, indiferent de genotip,
Harvoni 1 cp/zi, 12 săptămâni
Maviret 3 cp/zi 8 săptămâni
b. experimentaţi la interferon + ribavirina oricare genotip în afara de genotipul 3
Harvoni 1 cp/zi, 12 săptămâni
Maviret 3 cp/zi 12 săptămâni
c. experimentaţi la interferon + ribavirina genotip 3
Harvoni 1 cp/zi, 12 săptămâni
Maviret 3 cp/zi 16 săptămâni
3. Pacienţii infectaţi VHC posttransplant hepatic,
Harvoni 1 cp/zi 12 săptămâni
Maviret 3 cp/zi 12 săptămâni la orice genotip cu excepţia genotipului 3
Maviret 3 cp/zi 16 săptămâni la prezenţa genotipului 3
Genotiparea ramâne o decizie a medicului prescriptor şi ţine cont de factorii de risc asociaţi infecţiei
VHC.
10
Notă
1. Evaluarea pre-terapeutică, monitorizarea tratamentului şi criteriile de evaluare a rezultatului
medical sunt conform pct. 2, 6 si 7 de la cap I sau II
2. Contraindicaţiile specifice pentru pacienţii pediatrici sunt legate de aprobarea tipul de medicaţie
antivirală cu acţiune directă pentru vârsta pediatrică
PRESCRIPTORI
Medicii pediatri cu supraspecializare/competenţă/atestat în gastroenterologie pediatrică, medicii din
specialitatea gastroenterologie pediatrică şi medicii din specialitatea boli infecţioase aflaţi în relaţii
contractuale cu casele de asigurări de sănătate din judetele Bucureşti, Bihor, Braşov, Cluj, Constanţa, Dolj,
Galaţi, Iaşi, Mureş, Sibiu, Timiş şi CAS AOPSNAJ.”
Cele mai noi stiri medicale: