Protocol terapeutic
conform ordin MS/CNAS NR 564/499/2021
A16AX14 – DCI MIGALASTATUM
A16AX14 – DCI MIGALASTATUM
Citeste mai mult: https://www.formaremedicala.ro/a16ax14-dci-migalastatum/
Boala Fabry este o afecţiune rară, progresivă, multisistemică, gravă şi extrem de debilitantă,
punând în pericol viaţa. Transmiterea sa este legată de cromozomul X fiind caracterizată prin
acumularea lizozomală progresivă, care afectează bărbaţii şi femeile.
Mutaţiile genei GLA, care se află la originea bolii Fabry, determină un deficit al enzimei
lizozomale alfa-galactozidază A (alfa-Gal A) care este necesară pentru metabolismul
substraturilor glicosfingolipidice (de exemplu, GL-3, lyso-Gb3). Prin urmare, reducerea activităţii
alfa-Gal A este asociată cu acumularea progresivă de substrat în organele şi ţesuturile
vulnerabile, ceea ce duce la morbiditatea şi mortalitatea asociate cu boala Fabry.
Anumite mutaţii ale genei GLA pot avea ca rezultat producerea unor forme mutante
instabile ale alfa-Gal A, caracterizate printr-o pliere anormală.
I. Criterii de eligibilitate pentru includerea în tratamentul cu migalastat
În boala Fabry imaginea clinică acoperă un întreg spectru de severitate, variind de la forme
uşoare (mai frecvente la femei heterozigote), cu forme severe (în special la bărbaţii hemizigoţi)
prezentând manifestări caracteristice. Prezentarea clinică este variabilă. Odată cu vârsta,
deteriorarea progresivă poate duce la eşecul organic. Insuficienţa renală în stadiu terminal şi
complicaţiile cardio-cerebrovasculare pot pune viaţa în pericol.
1. Principalele manifestări din boala Fabry sunt:
– Renale: proteinurie, disfuncţii tubulare, insuficienţă renală cronică până la stadiul de
uremie (decadele 4 – 5);
– Cardiace: cardiomiopatie hipertrofică, aritmii, angor, infarct miocardic, insuficienţă
cardiacă;
– Neurologice: acroparestezii, hipo sau anhidroză, intoleranţă la frig/căldură, accidente
vasculare cerebrale ischemice;
– Gastrointestinale: crize dureroase abdominale, diaree, greţuri, vomă, saţietate precoce;
– ORL: hipoacuzie neurosenzorială progresivă, surditate unilaterală busc instalată, acufene,
vertij
– Pulmonare: tuse, disfuncţie ventilatorie obstructivă;
– Cutanate: angiokeratoame;
– Oculare: opacităţi corneene (cornea verticillata), cristaliniene, modificări vasculare
retiniene;
– Osoase: osteopenie, osteoporoză.
2. Criterii de confirmare a diagnosticului de boală Fabry:
Diagnosticul este stabilit pe baza diagnosticului enzimatic, prin determinarea nivelului de
activitate a alfa galactozidazei A. Un nivel scăzut al activităţii enzimatice sau chiar absenţa
acesteia confirmă boala; diagnosticul molecular care, prin analiza ADN, permite identificarea
mutaţiilor. O menţiune specială se impune referitor la femeile purtătoare (heterozigote) ale genei
mutante, la care nivelul de activitate al enzimei se situează la limita inferioară a normalului; la
acestea este necesară analiza ADN pentru identificarea mutaţiilor în vederea precizării stării de
purtător.
– subiecţi de sex masculin: nivel scăzut al activităţii α-galactozidazei A în plasmă şi
leucocite.
– subiecţi de sex feminin: nivel scăzut al activităţii α-galactozidazei A în plasmă şi
leucocite şi/sau mutaţie la nivelul genei GLA ce codifică α-galactozidaza A.
Sunt eligibili pentru includerea în tratamentul cu migalastat pacienţii cu diagnostic cert
de boală Fabry care prezintă o mutaţie sensibilă (“amenable mutation”).
3. Indicaţiile terapiei cu migalastat în boala Fabry (anexa 1):
Migalastatul este un şaperon farmacologic conceput pentru a se lega selectiv şi reversibil, cu
afinitate crescută, de situsurile active ale anumitor forme mutante ale genei alfa-Gal A, ale căror
genotipuri sunt denumite mutaţii sensibile.
Legarea migalastatului stabilizează formele mutante ale genei alfa-Gal A din reticulul
endoplasmic şi uşurează transferul normal al acestora către lizozomi. Odată acestea ajunse în
lizozomi, descompunerea migalastatului restabileşte activitatea alfa-Gal A, ducând la
catabolizarea GL-3 şi a substraturilor asociate.
Migalastat este indicat pentru tratamentul de lungă durată al adulţilor şi adolescenţilor în
vârstă de cel puţin 16 ani, cu diagnostic confirmat de boală Fabry (deficit de alfagalactozidază A) şi care prezintă o mutaţie sensibilă (“amenable mutation”).
Mutaţiile genei GLA sensibile şi non-sensibile la tratamentul cu Migalastat sunt enumerate în
rezumatul caracteristicilor produsului. Mutaţiile genei GLA sunt disponibile şi furnizorilor de
servicii de sănătate la adresa www.migalastatamenabilitytable.com.
Modificările menţionate privind nucleotidele reprezintă modificări potenţiale ale secvenţei ADN,
care determină mutaţia la nivelul aminoacizilor. Mutaţia la nivelul aminoacizilor (modificarea
secvenţei proteice) este cel mai relevantă în stabilirea susceptibilităţii la tratament:
• Dacă o dublă mutaţie este prezentă în acelaşi cromozom (la bărbaţi şi femei), pacientul
respectiv este sensibil în cazul în care dubla mutaţie este înscrisă ca menţiune separată;
• Dacă o dublă mutaţie este prezentă în doi cromozomi diferiţi (doar la femei), acel pacient
este sensibil în cazul în care oricare dintre mutaţiile individuale este sensibilă.
4. Obiectivele terapiei cu migalastat în boala Fabry (anexa 1, anexa 2):
• ameliorarea simptomatologiei şi
• prevenirea complicaţiilor tardive ale bolii Fabry.
• Rezultatele terapiei cu migalastat privind funcţia renală:
În studiul de fază 3 (ATTRACT) cu tratament anterior cu TSE (terapia de substituţie
enzimatică), funcţia renală a rămas stabilă pe parcursul celor 18 luni de tratament cu
Migalastat. În studiul de fază 3 (FACETS) fără tratament anterior cu TSE şi în faza de
extensie deschisă: Funcţia renală a rămas stabilă pe parcursul a până la 5 ani de
tratament cu migalastat.
• Rezultatele privind funcţia cardiacă Indexul masei ventriculului stâng (IMVS):
După 18 luni de tratament cu Migalastat, în studiul de fază 3 (ATTRACT) cu tratament
anterior cu TSE s-a observat o scădere semnificativă din punct de vedere statistic a IMVS.
În studiul de fază 3 (FACETS) fără tratament anterior cu TSE: tratamentul cu Migalastat a
avut drept rezultat o scădere semnificativă din punct de vedere statistic a IMVS.
• Rezultatele privind reducerea substraturilor asociate bolii: În studiul de fază 3
(ATTRACT) cu tratament anterior TSE şi în studiul de fază 3 (FACETS) fără tratament
anterior cu TSE: tratamentul cu Migalastat a dus la scăderi semnificative din punct de
vedere statistic ale concentraţiilor plasmatice de lyso-Gb3 şi ale incluziunilor GL-3 în
capilarele interstiţiale renale la pacienţii cu mutaţii sensibile.
• Pe parcursul celor 12 luni de tratament cu Migalastat au fost observate reduceri calitative
ale concentraţiilor GL-3 în mai multe tipuri de celule renale: podocite, celule mezangiale
şi, respectiv, celule endoteliale glomerulare.
• Criterii clinice compuse: În studiul cu tratament anterior TSE, o analiză a criteriilor
clinice compuse, constând din evenimente renale, cardiace şi cerebrovasculare sau deces,
a evidenţiat o frecvenţă a evenimentelor observate în grupul de tratament cu Migalastat de
29%, comparativ cu 44% în grupul TSE, pe o durată de 18 luni.
• Scala de evaluare a simptomelor gastrointestinale: tratamentul cu Migalastat a fost asociat
cu ameliorări semnificative din punct de vedere statistic comparativ cu placebo, de la
momentul iniţial la luna 6, în ceea ce priveşte diareea, precum şi cu ameliorări în ceea ce
priveşte refluxul la pacienţii care prezentau simptome la momentul iniţial.
• Health-Related Quality of Life (HRQOL) a rămas stabilă peste 18 luni de tratament cu
Migalastat la pacienţii trecuţi de la tratament anterior cu TSE. La pacienţii netrataţi
anterior cu TSE (FACETS), Migalastat a produs îmbunătăţiri semnificative în domeniile
vitalităţii şi sănătăţii generale ale chestionarului Health Status Questionnaire (SF-36) la
18/24 luni.
II. Stabilirea schemei de tratament cu migalastat la pacienţii cu boală fabry
Doze migalastat: schema de dozare recomandată la adulţi şi adolescenţi cu vârsta de cel
puţin 16 ani este de 123 mg migalastat (1 capsulă) o dată la două zile, la aceeaşi oră.
Doză omisă de migalastat nu trebuie luată în 2 zile consecutive. Dacă se omite complet doza
aferentă unei zile, pacientul trebuie să ia doza omisă de migalastat numai dacă se află în
intervalul de 12 ore de la ora normală la care este luată doza. Dacă au trecut mai mult de 12 ore,
pacientul trebuie să reia administrarea migalastat în următoarea zi şi la următoarea oră de
administrare programată, conform schemei de administrare o dată la două zile.
Mod de administrare migalastat: expunerea scade cu aproximativ 40% atunci când se
administrează împreună cu alimente, prin urmare nu trebuie consumate alimente cu cel puţin 2
ore înainte şi 2 ore după administrarea migalastat, pentru a exista un repaus alimentar de
minim 4 ore. În această perioadă se pot consuma lichide clare, inclusiv băuturi carbogazoase.
Pentru asigurarea unor beneficii optime pentru pacient, migalastat trebuie luat o dată la două zile,
la aceeaşi oră. Capsulele trebuie înghiţite întregi. Capsulele nu trebuie tăiate, sfărâmate sau
mestecate.
Durata tratamentului cu migalastat: este indefinită, în principiu, pe tot parcursul vieţii.
III. Criterii de excludere din tratamentul cu migalastat (anexa 1, anexa 2)
• Se recomandă monitorizarea periodică a funcţiei renale, a parametrilor ecocardiografici şi
a markerilor biochimici (o dată la 6 luni) la pacienţii care au început tratamentul cu
migalastat sau care au fost trecuţi la acest tratament.
• În cazul unei deteriorări clinice semnificative, trebuie avută în vedere evaluarea clinică
suplimentară sau întreruperea tratamentului cu migalastat.
• Migalastat este contraindicat la pacienţii cu mutaţii non-sensibile.
• Reacţii adverse severe la medicament
D. EVALUAREA ŞI MONITORIZAREA PACIENŢILOR CU BOALA FABRY LA
INIŢIEREA ŞI PE PARCURSUL TERAPIEI CU MIGALASTAT
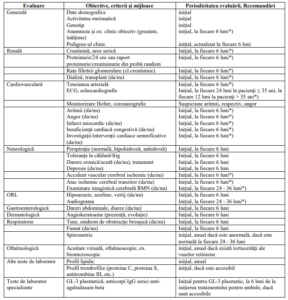

Notă
*) Evaluare necesară la modificare schemei terapeutice sau la apariţia unor complicaţii/evenimente renale, cardiovasculare
sau cerebrovasculare
IV. Evaluarea şi monitorizarea pacienţilor cu boală fabry ce nu beneficiază de tratament cu
MIGALASTAT se face conform criteriilor şi mijloacelor expuse la punctul D, dar cu
periodicitate anuală.
V. Măsuri terapeutice adjuvante şi preventive pentru cele mai importante manifestări ale
BOLII FABRY
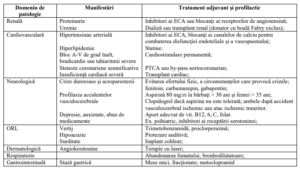
VI. Prescriptori
Medicii din specialităţile nefrologie, cardiologie, genetica medicală, neurologie şi pediatrie.
Anexa Nr. 1
REFERAT DE JUSTIFICARE
În atenţia Comisiei Naţionale pentru aprobarea tratamentului în boala Fabry
– BOALA FABRY –
FO nr. Aflat în evidenţă din …..
Număr dosar/
Pacient
Nume ………………………………………… Prenume ……………………………………..
Data naşterii ………………………………… CNP ………………………..
Adresa …………………………………………………………..
Telefon …………………..
Casa de Asigurări de Sănătate …………………………………………
Medic curant
Nume ……………………………….. Prenume ………………………………….. CNP ………………………………
Parafa şi semnătura ……………….
Specialitatea ………………………..
Unitatea sanitară …………………..
1. Solicitare:
Iniţială: Da Nu
În continuare: Da Nu
Doza de Migalastatul recomandată ……………………..
2. Date clinice
Talia …………….. (cm)
Greutatea …………. (Kg)
Data debutului clinic ……………..
Data confirmării diagnosticului …….
Metoda de diagnostic utilizată:
– determinarea activităţii alfa-galactozidazei plasmatice şi leucocitare – valori …………./(valori de referinţă ale
laboratorului ………..)
Se anexează în copie buletinul de analiză)
– Analiza ADN: mutaţia identificată …………..
Se anexează în copie buletinul de analiză)
3. Evaluarea renală
Data …………………..
Creatinina serică ……….
Uree serică …………….
Proteinurie …………….
Creatininurie …………..
Clearance creatininic ……
Dializă Da Nu
Transplant renal Da Nu
4. Evaluarea cardiovasculară
Data …………………..
Tensiunea arterială ……..
Cardiomiopatie hipertrofică Da Nu
Aritmii Da Nu
Angor Da Nu
Infarct miocardic Da Nu
Insuficienţă cardiacă congestivă Da Nu
Electrocardiogramă Da Nu
Ecocardiografie Da Nu
Investigaţii/intervenţii cardiace semnificative Da Nu
5. Evaluarea neurologică
Data …………………..
Perspiraţie (normală, hipohidroză, anhidroză) ……….
Toleranţa la căldură/frig ………….
Durere cronică/acută ………………
Tratament antialgic ……………….
Depresie Da Nu
Accident vascular cerebral Da Nu
Atac ischemic cerebral tranzitor Da Nu
Examinare imagistică cerebrală Da Nu
6. Evaluare ORL
Data …………………..
Hipoacuzie/Surditate Da Nu
Acufene Da Nu
Vertij Da Nu
Audiograma Da Nu
7. Evaluare gastroenterologică
Data …………………..
Dureri abdominale Da Nu
Diaree Da Nu
8. Evaluare dermatologică
Data …………………..
Angiokeratoame (prezenţă, evoluţie)
9. Evaluare respiratorie
Data …………………..
Tuse Da Nu
Sindrom de obstrucţie bronşică Da Nu
Spirometrie Da Nu
10. Evaluare oftalmologiei
Data …………………..
Acuitate vizuală Da Nu
Oftalmoscopie Da Nu
Ex. biomicroscopic Da Nu
11. Durere/calitatea vieţii (chestionare)
Data completării ………………
Chestionar “Inventar sumar al durerii”
Chestionar de sănătate mos-36 (SF-36)
Chestionar PedsQL (copii)
12. Efecte adverse ale terapiei cu Migalastatul (până la data actualei evaluări) …………………….
13. Alte afecţiuni (în afară de boala Fabry) ……………………..
………………………………………………………………………………………………………………………………………………….
14. Scurtă prezentare de către medicul curant a aspectelor esenţiale privind istoricul şi evoluţia bolii la pacientul
respectiv
………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………….
15. Tratamentul recomandat în boala Fabry:
Migalastatul
Doza recomandată: 1 cps (123 mg) migalastat o dată la 2 zile, la aceeaşi oră, conform Indicaţiilor terapiei cu
migalastat în boala Fabry (punct 3) şi anexa 1.
Perioada de tratament recomandată: în funcţie de reevaluarea de la fiecare 6 luni, posibil toată viaţa.
Nr. total de ambalaje blister a 14 cps pentru 28 zile Migalastat a 123 mg 7 pentru perioada recomandată.
16. Alte observaţii referitoare la tratament
………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………….
Semnătura şi parafa medicului curant
Anexa Nr. 2
CONSIMŢĂMÂNT INFORMAT
Subsemnatul …………………………, CNP ……………, domiciliat în ……………….., telefon
…………….. suferind de boala Fabry cu care am fost diagnosticat din data de …………., am fost pe
deplin informat în legătură cu manifestările şi complicaţiile posibile ale bolii.
Am fost pe deplin informat asupra beneficiilor tratamentului cu Migalastatul privind
ameliorarea simptomelor actuale şi prevenirea complicaţiilor ulterioare.
De asemenea, am fost informat în legătură cu necesitatea administrării pe cale orală
tratamentului cu Migalastatul o dată la două zile, la aceeaşi oră, pe termen nelimitat, precum şi în
legătură cu riscurile acestui tratament.
Mă angajez să respect cu stricteţe toate prescripţiile medicale legate de tratamentul cu
Migalastatul şi măsurile adjuvante şi profilactice.
Mă angajez să respect cu stricteţe recomandările privind evaluările medicale periodice
necesare pe tot parcursul administrării tratamentului cu Migalastatul.
Sunt de acord să mi se aplice tratamentul cu Migalastatul, precum şi cu condiţionările
aferente menţionate mai sus.
Nume prenume pacient,
Semnătura,
Nume prenume medic curant,
Semnătura,
Data ……………………
Cele mai noi stiri medicale:










