I. Indicații
Terapia de substituție enzimatică la pacienții cu lipofuscinoză ceroidă neuronală de tip 2 (LCN2),
afecțiune denumită și deficit de tripeptidil peptidază-1 (TPP1).
Persoanele afectate de boala LCN2 nu au enzima numită TPP1 sau au un nivel foarte scăzut al acestei
enzime, ceea ce determină o acumulare de substanțe numite materiale de stocare lizozomală. La
persoanele cu boala LCN2, aceste materiale se acumulează în anumite părți ale corpului, în principal în
creier.
Acest medicament înlocuiește enzima lipsă, TPP1, ceea ce micșorează acumularea materialelor de
stocare lizozomală. Acest medicament acționează prin încetinirea evoluției bolii.
Fiecare flacon de conține cerliponază alfa 150 mg în 5 ml de soluție (30 mg/ml)
II. Criterii de includere în tratament
• Pacientii care au un diagnostic de lipofuscinoză ceroidă neuronală de tip 2 (LCN2), confirmat in
urma evaluării activității enzimei TPP1
• *In Europa sunt clinici unde se trateaza si la scor 0 sau 1, decizia apartinand medicului
• Există consimțământul scris al părintelui sau tutorelui legal și acordul acestuia, dacă este cazul.
• Parintele sau apartinatorul legal au capacitatea de a respecta cerințele protocolului, în opinia
medicului curant.
III. Criterii de excludere:
• Pacientul are o altă boală neurologică moștenită, de ex. alte forme de LCN sau convulsii fără
legătură cu LCN2
• Pacientul are o altă boală neurologică care poate fi cauza declinului cognitiv (de exemplu,
traume, meningită, hemoragie)
• Necesită suport de ventilație, cu excepția suportului neinvaziv noaptea
• Are contraindicații pentru neurochirurgie (de exemplu boli cardiace congenitale, insuficiență
respiratorie severă sau anomalii de coagulare)
• Are contraindicații pentru RMN (de exemplu stimulator cardiac, fragment de metal sau cip în
ochi, anevrism în creier)
• Pacientul are infecții severe (de exemplu, pneumonie, pielonefrită sau meningită),
administrarea tratamentului poate fi amânată
• Pacientul este predispus la complicații după administrarea de medicamente intraventriculare,
inclusiv la pacienții cu hidrocefalie sau șunturi ventriculare
• Are hipersensibilitate la oricare dintre componentele Cerliponasum alfa
• Are o afecțiune medicală sau o circumstanță care, în opinia medicului curant, ar putea
compromite capacitatea subiectului de a respecta protocolul terapeutic.
• Refuzul pacientului sau reprezentantului legal de a primi tratamentul cu Cerliponasum alfa.
Precautii speciale
Vârsta mai mică de 2 ani. Sunt disponibile date limitate pentru copiii cu vârsta de 2 ani și nu sunt
disponibile date pentru copiii cu vârsta sub 2 ani. Tratamentul trebuie realizat în funcție de beneficiile și
riscurile fiecărui pacient, așa cum sunt evaluate de către medic.
IV. Tratament
Doze și mod de administrare
Cerliponasum alfa trebuie administrat doar de către un profesionist din domeniul sănătății cu cunoștințe
despre administrarea pe cale intracerebroventriculară, și în cadrul unei unități medicale.
Doze
Doza recomandată este de 300 mg cerliponază alfa, administrată la interval de două săptămâni prin
perfuzie intracerebroventriculară.
În cazul pacienților cu vârsta sub 2 ani, se recomandă doze mai mici, (a se consulta RCP produs)
Se recomandă ca în decurs de 30 până la 60 de minute înainte de inițierea perfuziei, pacienții să
primească pre-tratament cu antihistaminice, însoțite sau nu de antipiretice.
Continuarea tratamentului pe termen lung trebuie să se producă în condițiile unei evaluări clinice
periodice, chiar dacă se consideră că beneficiile depășesc riscurile posibile pentru anumiți pacienți.
Ajustări ale dozei
Ar putea fi necesar să fie avute în vedere ajustări ale dozei în cazul pacienților care nu pot tolera
perfuzia. Doza poate fi redusă cu 50% și/sau viteza de administrare a perfuziei poate fi scăzută la un ritm
mai lent.
Dacă perfuzia este întreruptă din cauza unei reacții de hipersensibilitate, aceasta trebuie reluată la
aproximativ jumătate din ritmul inițial al perfuziei la care s-a produs reacția de hipersensibilitate.
Perfuzia trebuie întreruptă și/sau ritmul perfuziei trebuie încetinit în cazul pacienților care, în opinia
medicului care administrează tratamentul, prezintă o posibilă creștere a tensiunii intracraniene în timpul
perfuziei, sugerată de simptome precum cefalee, greață, vărsături sau o stare mentală redusă. Aceste
măsuri de precauție sunt foarte importante în cazul pacienților cu vârste sub 3 ani.
Copii și adolescenți
Siguranța și eficacitatea cerliponaza alfa la copiii cu vârsta sub 3 ani nu au fost încă stabilite. Sunt
disponibile date limitate pentru copiii cu vârsta de 2 ani și nu sunt disponibile date pentru copiii cu vârsta
sub 2 ani. Dozele propuse pentru copiii sub 2 ani au fost estimate în funcție de masa creierului.
Tratamentul cu Cerliponasum alfa a fost inițiat la copiii cu vârste cuprinse între 2 și 8 ani în cadrul
studiilor clinice. Sunt disponibile date limitate despre pacienții cu vârste mai mari de 8 ani. Tratamentul
trebuie realizat în funcție de beneficiile și riscurile fiecărui pacient, așa cum sunt evaluate de către medic.
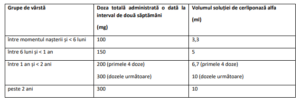
Dozele se stabilesc în funcție de vârsta pacienților la momentul tratamentului și trebuie ajustate în mod
corespunzător (vezi Tabel 1).
Tabel 1: Doza și volumul de Cerliponasum alfa
Mod de administrare
Utilizare intracerebroventriculară.
Precauții care trebuie luate înainte de manipularea sau administrarea medicamentului
O tehnică aseptică trebuie respectată cu strictețe în timpul pregătirii și administrării.
Cerliponasum alfa și soluția de spălare trebuie administrate exclusiv pe cale intracerebroventriculară.
Fiecare flacon de Cerliponasum alfa și de soluție de spălare este conceput ca un produs de unică
folosință.
Cerliponasum alfa se administrează în lichidul cefalorahidian (LCR) sub formă de perfuzie, prin
intermediul unui rezervor și unui cateter implantat chirurgical (dispozitiv de acces
intracerebroventricular). Dispozitivul de acces intracerebroventricular ar trebui să fie implantat înainte
de administrarea primei perfuzii. Dispozitivul de acces intracerebroventricular implantat ar trebui să fie
adecvat pentru a asigura accesul la ventriculele cerebrale în scopul administrării terapeutice.
După administrarea perfuziei de Cerliponasum alfa, trebuie utilizată o cantitate calculată de soluție de
spălare pentru spălarea componentelor perfuziei, inclusiv dispozitivul de acces intracerebroventricular,
în vederea administrării complete a soluției de Cerliponasum alfa și pentru menținerea permeabilității
dispozitivului de acces intracerebroventricular. Flacoanele de Cerliponasum alfa și de soluție de spălare
trebuie decongelate înainte de administrare. Ritmul de administrare a perfuziei pentru Cerliponasum alfa
și soluția de spălare este de 2,5 ml/oră. Timpul total de administrare a perfuziei, incluzând Cerliponasum
alfa și soluția de spălare necesară, este de aproximativ 2 până la 4,5 ore, în funcție de doză și de volumul
administrat.
Administrarea perfuziei intracerebroventriculare cu Cerliponasum alfa
Administrați Cerliponasum alfa înainte de soluția de spălare.
1. Marcați linia de perfuzie cu eticheta „Exclusiv pentru perfuzie intracerebroventriculară”.
2. Atașați seringa care conține Cerliponasum alfa la linia de extensie, dacă se utilizează o linie de
extensie; în caz contrar, conectați seringa la setul de perfuzie. Setul de perfuzie trebuie să fie
echipat cu un filtru de linie de 0,2 μm. Vezi Figura 1.
3. Amorsați componentele perfuziei cu Cerliponasum alfa.
4. Inspectați scalpul pentru semne de scurgeri sau blocare a dispozitivului de acces
intracerebroventricular și pentru posibile infecții. Nu administrați Cerliponasum alfa în cazul în care
există semne sau simptome de scurgeri ale dispozitivului de acces intracerebroventricular, probleme
cu acesta sau infecții cauzate de acesta (vezi Contraindicatii și Atenționări și precauții speciale
pentru utilizare).
5. Pregătiți scalpul pentru perfuzia intracerebroventriculară, utilizând o tehnică aseptică conformă cu
standardul terapeutic al instituției respective.
6. Introduceți acul portului de perfuzare în dispozitivul de acces intracerebroventricular.
7. Conectați o seringă sterilă goală separată (nu mai mare de 3 ml) la acul portului de perfuzare.
Extrageți 0,5 ml până la 1 ml de LCR pentru a verifica permeabilitatea dispozitivului de acces
intracerebroventricular. • Nu retrageți LCR înapoi în dispozitivul de acces intracerebroventricular.
Probele de LCR trebuie trimise ca procedură de rutină pentru monitorizarea infecțiilor (vezi
Atenționări și precauții speciale pentru utilizare).
8. Atașați setul de perfuzie la acul portului de perfuzare (vezi Figura 1). • Securizați componentele
conform standardului terapeutic al instituției.
9. Așezați seringa care conține Cerliponasum alfa în pompa de seringă și programați pompa să
funcționeze la un ritm de perfuzare de 2,5 ml pe oră. • Programați alarma pompei să se declanșeze
la cele mai sensibile setări pentru limitele de presiune, ritm de perfuzare și volum. Pentru detalii,
consultați manualul utilizatorului furnizat de producătorul pompei de seringă.
A nu se administra ca bolus sau manual.
10. Inițiați perfuzia cu Cerliponasum alfa la un ritm de perfuzare de 2,5 ml pe oră.
11. Inspectați periodic sistemul de perfuzare în timpul administrării perfuziei pentru semne de scurgere
sau întrerupere a administrării.
12. Verificați ca seringa cu „Cerliponasum alfa” din pompa de seringă să fie goală după terminarea
perfuziei. Detașați și îndepărtați seringa goală de pompă și deconectați-o de tubulatură. Eliminați
seringa goală în conformitate cu cerințele locale.
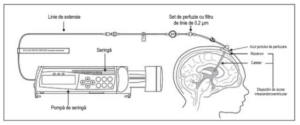
Figura 1: Montarea sistemului de perfuzare
Perfuzie intracerebroventriculară cu soluția de spălare
Administrați soluția de spălare furnizată după finalizarea perfuziei cu Cerliponasum alfa.
1. Atașați la componentele perfuziei seringa care conține volumul calculat de soluție de spălare.
2. Așezați seringa care conține soluția de spălare în pompa de seringă și programați pompa să
funcționeze la un ritm de perfuzare de 2,5 ml pe oră. • Programați alarma pompei să se declanșeze
la cele mai sensibile setări pentru limitele de presiune, ritm de perfuzare și volum. Pentru detalii,
consultați manualul utilizatorului furnizat de producătorul pompei de seringă.
A nu se administra ca bolus sau manual.
3. Inițiați perfuzia cu soluția de spălare la un ritm de perfuzare de 2,5 ml pe oră.
4. Inspectați periodic componentele sistemului de perfuzare în timpul administrării perfuziei pentru
semne de scurgere sau întrerupere a administrării.
5. Verificați ca seringa cu „soluție de spălare” din pompa de seringă să fie goală după terminarea
perfuziei. Detașați și îndepărtați seringa goală de pompă și deconectați-o de linia de perfuzie.
6. Îndepărtați acul portului de perfuzare. Aplicați o ușoară presiune și un bandaj la locul administrării
perfuziei, conform standardului terapeutic al instituției.
7. Eliminați componentele sistemului de perfuzie, acele, soluțiile nefolosite și alte materiale reziduale
în conformitate cu cerințele locale.
Contraindicații
Reacție anafilactică, care poate pune viața în pericol, la substanța activă sau la oricare dintre excipienții
Cerliponasum alfa, dacă încercarea de reluare a administrării nu reușește (vezi
Atenționări și precauții speciale pentru utilizare).
Pacienți cu LCN2 cu șunt ventriculo-peritoneal.
Cerliponasum alfa nu trebuie administrat în măsura în care există semne de scurgere acută la nivelul
dispozitivului de acces intracerebroventricular, dispozitivul este defect sau apare o infecție asociată
dispozitivului (vezi Doze și mod de administrare și Atenționări și precauții speciale pentru utilizare).
Atenționări și precauții speciale pentru utilizare
Complicații asociate cu dispozitivul
La pacienții tratați cu Cerliponasum alfa au fost observate cazuri de apariție a unor infecții asociate cu
dispozitivul de acces intracerebroventricular, inclusiv infecții subclinice și meningită. Meningita poate să
prezinte următoarele simptome: febră, cefalee, rigiditate la nivelul gâtului, fotosensibilitate, greață,
vărsături și modificări ale stării mentale. Probele de LCR trebuie trimise pentru analiză, ca procedură de
rutină, în vederea depistării unor infecții subclinice asociate cu dispozitivul folosit. În studiile clinice, au
fost administrate antibiotice, dispozitivul de acces intracerebroventricular a fost înlocuit, iar tratamentul
cu Cerliponasum alfa a fost continuat.
Înainte de fiecare perfuzie, profesioniștii din domeniul sănătății trebuie să verifice integritatea pielii la
nivelul scalpului pentru a se asigura că dispozitivul de acces intracerebroventricular nu este compromis.
Printre semnele frecvente ale scurgerilor la nivelul dispozitivului și ale funcționării incorecte a
dispozitivului se numără inflamare, eritem la nivelul scalpului, extravazarea lichidului sau o protuberanță
pe scalp în jurul sau deasupra dispozitivului de acces intracerebroventricular. Totuși, aceste semne pot să
apară și în contextul infecțiilor asociate cu dispozitivul.
Locul administrării perfuziei trebuie examinat și permeabilitatea dispozitivului trebuie verificată pentru a
se depista dacă există scurgeri la nivelul dispozitivului de acces intracerebroventricular și/sau dacă acest
dispozitiv funcționează incorect, înainte de inițierea perfuziei cu Cerliponasum alfa (vezi Doze și mod de
administrare și Contraindicații). Semnele și simptomele infecțiilor asociate cu dispozitivul pot să nu fie
evidente, fapt pentru care probe de LCR trebuie trimise pentru analiză, ca procedură de rutină, în
vederea depistării unor infecții subclinice asociate cu dispozitivul folosit. Pentru confirmarea integrității
dispozitivului, ar putea fi necesară consultarea cu un medic neurochirurg. Tratamentul trebuie întrerupt
în cazul în care dispozitivul nu mai funcționează corect și poate fi necesară înlocuirea dispozitivului de
acces înainte de administrarea perfuziilor următoare.
După perioade îndelungate de utilizare apare degradarea materialelor rezervorului dispozitivului de
acces intracerebroventricular, în conformitate cu rezultatele preliminare ale testelor realizate în
laborator și conform observațiilor din studiile clinice, la aproximativ 4 ani de utilizare.
Înlocuirea dispozitivelor de acces trebuie avută în vedere înainte de sfârșitul perioadei de 4 ani de
administrare regulată a Cerliponasum alfa și, în orice caz, trebuie să se garanteze întotdeauna că
dispozitivul de acces intracerebroventricular se utilizează în conformitate cu prevederile producătorului
dispozitivului medical respectiv.
În cazul în care apar complicații asociate cu dispozitivul de acces intracerebroventricular, consultați
recomandările producătorului pentru mai multe instrucțiuni.
Se impune prudență în cazul pacienților predispuși la complicații în urma administrării medicamentului
intracerebroventricular, inclusiv pacienții cu hidrocefalie obstructivă.
V. Monitorizarea tratamentului
Monitorizare clinică și paraclinică
Semnele vitale trebuie monitorizate înainte de inițierea perfuziei, periodic pe parcursul administrării
perfuziei și după terminarea perfuziei, în cadrul unei unități de asistență medicală. După terminarea
perfuziei, starea pacientului trebuie evaluată clinic și ar putea fi necesară menținerea sub observație
pentru perioade mai îndelungate de timp dacă este clinic indicat, în special în cazul pacienților cu vârsta
sub 3 ani.
Monitorizarea prin electrocardiogramă (ECG) în perioada administrării perfuziei trebuie realizată în cazul
pacienților cu antecedente de bradicardie, tulburare de conducere sau cu o afecțiune cardiacă
structurală, deoarece unii pacienți cu LCN2 ar putea dezvolta tulburări de conducere sau boli cardiace. La
pacienții cardiaci obișnuiți, este necesar să se efectueze evaluări periodice prin ECG în 12 derivații o dată
la 6 luni.
Probele de LCR trebuie trimise pentru analiză, ca procedură de rutină, în vederea depistării unor infecții
subclinice asociate cu dispozitivul folosit (vezi Doze și mod de administrare).
Tabel 2: Scala de evaluare clinică a LCN2

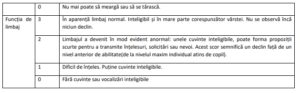
Copii și adolescenți
În momentul inițierii tratamentului, nu au existat în studiile clinice pacienți cu o evoluție avansată a bolii
și nu sunt disponibile date clinice în cazul copiilor cu vârste < 2 ani. Pacienții cu o afecțiune LCN2
avansată și nou născuții ar putea prezenta o integritate diminuată a barierei hematoencefalice. Nu sunt
cunoscute efectele unei expuneri potențial crescute la medicament asupra sistemului periferic.
Reacție anafilactică
Nu au fost raportate cazuri de reacție anafilactică în urma utilizării Cerliponasum alfa în studiile clinice;
cu toate acestea, riscul de reacție anafilactică nu poate fi exclus. Profesioniștii din domeniul sănătății
trebuie să aibă în vedere următoarele simptome posibile ale unei reacții anafilactice: urticarie
generalizată, prurit sau congestionare, inflamarea buzelor, a limbii și/sau a uvulei, dispnee,
bronhospasm, stridor, hipoxemie, hipotonie, sincopă sau incontinență. Ca măsură de precauție, în timpul
administrării trebuie să existe un suport medical corespunzător în apropiere, pregătit pentru utilizare.
Dacă se produce o reacție anafilactică, este necesar să se acționeze cu prudență în momentul reluării
administrării.
Conținutul de sodiu
Acest medicament conține 44 mg de sodiu per flacon de Cerliponasum alfa și de soluție de spălare. Acest
aspect trebuie avut în vedere în cazul pacienților cu un aport de sodiu controlat în regimul alimentar.
Interacțiuni cu alte medicamente și alte forme de interacțiune
Nu s-au efectuat studii privind interacțiunile. Cerliponaza alfa este o proteină umană recombinantă, iar
expunerea sistemică este limitată datorită administrării pe cale intracerebroventriculară, prin urmare
este puțin probabil să se producă interacțiuni între cerliponaza alfa și medicamentele metabolizate de
enzimele citocromului P450.
Fertilitatea, sarcina și alăptarea
Nu există date disponibile referitoare la utilizarea Cerliponasum alfa la femeile gravide. În timpul
tratamentului, alăptarea trebuie întreruptă.
Nu au fost efectuate studii de fertilitate cu cerliponază alfa, nici la animale nici la om.
Efecte asupra capacității de a conduce vehicule și de a folosi utilaje
Nu au fost efectuate studii privind efectul Cerliponasum alfa asupra capacității de a conduce vehicule sau
de a folosi utilaje.
VI. Întreruperea tratamentului
• In cazul în care apar reacții alergice care pot pune viața în pericol, la cerliponază alfa sau la
oricare dintre celelalte componente ale acestui medicament, iar reacțiile continuă să apară
atunci când se administrează din nou cerliponază alfa.
• Dacă pacientul are un dispozitiv implantat pentru drenarea lichidului acumulat în exces în zona
creierului.
• Dacă pacientul prezintă la momentul administrării semne ale unei infecții asociate cu dispozitivul
sau probleme cu dispozitivul. Se poate decide continuarea tratamentului după rezolvarea
infecției sau problemelor asociate cu dispozitivul.
Reacții adverse posibile
Reacții adverse foarte frecvente (pot afecta mai mult de 1 din 10 persoane):
– febră
– vărsături
– stare de iritabilitate
– convulsii (crize)
– reacții în timpul sau la scurt timp după administrarea medicamentului, precum urticarie,
mâncărimi sau congestionare, umflarea buzelor, a limbii și/sau a gâtului, scurtarea respirației,
răgușeală, învinețirea vârfurilor degetelor sau buzelor, scăderea tonusului muscular, leșin sau
incontinență
Reacții adverse frecvente (pot afecta până la 1 din 10 persoane):
– infecții bacteriene asociate cu dispozitivul
– încetinirea bătăilor inimii
– dispozitivul nu funcționează în mod corect din cauza unui blocaj detectat în timpul pregătirii
pentru infuzie
Frecvență necunoscută (frecvența nu poate fi estimată după datele disponibile)
– dispozitivul este dislocat și nu funcționează în mod corect în timpul pregătirii pentru infuzie
– inflamare a creierului din cauza unei infecții asociate cu dispozitivul
Acest medicament poate cauza și alte reacții adverse:
Reacții adverse foarte frecvente:
– durere de cap
– nivel crescut sau scăzut al proteinelor în lichidul din jurul creierului
– rezultate anormale ale activității electrice a inimii (ECG)
– celule mărite în lichidul spinal, detectate prin monitorizarea de laborator
– infecții ale nasului sau gâtului (răceală)
– probleme cu acul (acul de perfuzie cade din dispozitivul implantat)
Reacții adverse frecvente:
– durere
– erupție trecătoare pe piele
– urticarie
– „căderea în față” a capului (astfel că bărbia aproape că atinge pieptul)
– durere de stomac
– scurgeri ale dispozitivului
– vezicule apărute în gură sau pe limbă
– umflarea sau înroșirea pleoapelor și a albului ochilor
– stare de nervozitate
– tulburare la stomac sau în intestine
Raportarea reacțiilor adverse
Este necesară raportarea oricărei reacții adverse, inclusive reacții adverse nemenționate în acest
protocol. Reacțiile adverse se raportează direct prin intermediul sistemului național de raportare.
VII. Prescriptori
Medici specialisti in neurologie pediatrică din unitatile de specialitate prin care se deruleaza programul.